
【题目】常温下,下列溶液中的离子浓度关系式正确的是
A.pH =2的H2C2O4(二元弱酸)溶液与pH=12的NaOH溶液任意比例混合:c(Na+) + c(H+)= c(OH-) + c(![]() )
)
B.pH = a的氨水溶液中,c(NH3·H2O) = 10-a mol/L
C.新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
D.pH相同的①CH3COONa,②NaHCO3,③NaClO三种溶液的c(Na+):①>②>③
【答案】D
【解析】
A.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合,溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故A错误;
B.一水合氨为弱电解质,pH = a的氨水溶液中,c(NH3·H2O) > 10-a mol/L,故B错误;
C.新制氯水中含有HCl和HClO,两种酸电离导致溶液呈酸性,其中HCl完全电离,HClO部分电离,但电离程度较小,溶液呈酸性,溶液中氢氧根离子浓度很小,所以离子浓度大小顺序是c(H+)>c(Cl-),故C错误;
D.等浓度时对应酸的酸性越弱,水解程度越大,溶液的pH越大,酸性醋酸>碳酸>HClO,则pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液,盐溶液的浓度为①>②>③,其c(Na+)为①>②>③,故D正确;
故选D。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。
I.请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为________。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为_________(填化学式);
(3)元素①、③形成的18电子化合物的电子式为______;
(4)元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式);
(5)元素⑤、⑧的最高价氧化物对应的水化物的水溶液反应的离子方程式为_________。
II.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(6)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。铅蓄电池放电时正极是__(填物质化学式)。若电解液体积为2L(
(7)甲醛(HCHO)燃料电池的工作原理如下图所示。

①该电池工作时,b口通入的物质为________;
②该电池工作时,电子的流向为___________(填“从左到右”或“从右到左”);
③右侧电极的电极反应方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于加成反应的是
A.CH2=CH2 + Br2→CH2BrCH2Br
B.2CH3CH2OH +O2![]() 2CH3CHO + 2H2O
2CH3CHO + 2H2O
C.CH3CH2OH + 2Na →2CH3CH2ONa + H2↑
D.CH4 + 2O2![]() CO2 + 2H2O
CO2 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下难溶盐AgCl的饱和溶液中,![]() 与
与![]() 的物质的量浓度类似于水中
的物质的量浓度类似于水中![]() 和
和![]() 的关系,即
的关系,即![]() 常数),在下列溶液中:
常数),在下列溶液中:
a.![]()
![]() 溶液
溶液
b.![]()
![]() 盐酸
盐酸
c.![]()
d.![]() 溶液
溶液
则AgCl的溶解度由大到小的顺序为( )
A.abcdB.cbadC.dcabD.cbda
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
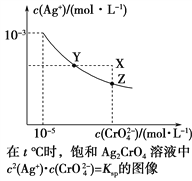
A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常数K=6.25×107
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念,判断下列叙述正确的是![]()
A.![]() 溶于水后能导电,故C
溶于水后能导电,故C![]() 为电解质
为电解质
B.![]() 、
、![]() 、
、![]() 、
、![]() 互为同素异形体
互为同素异形体
C.NaCl溶液和![]() 溶液均显中性,故两溶液中水的电离程度相同
溶液均显中性,故两溶液中水的电离程度相同
D.溶液与胶体本质区别为分散质微粒直径的大小不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取粗碘的某种工艺流程如图所示(部分操作名称已省略)。
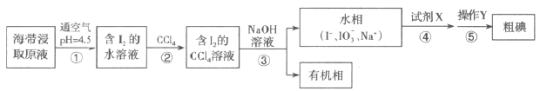
下列有关说法错误的是( )
A.步骤②的操作是萃取
B.步骤③的NaOH是还原剂
C.步骤④的试剂X是稀硫酸
D.步骤⑤的操作Y是过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的化工原料之一,自20世纪初以来,工业上合成氨主要依赖Haber-Bosch技术。探索新的合成氨的方法一直是重要课题。
(1)最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气。
已知:N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H = -a kJ/mol
H = -a kJ/mol
2H2(g) + O2(g) = 2H2O(1) ![]() H = -b kJ/mol
H = -b kJ/mol
写出上述固氮反应的热化学方程式:_______________。
(2)恒温、恒容条件下,在容器中模拟Haber-Bosch法合成氨,如下图(图中所示数据为初始物理量)。t分钟后反应达到平衡,生成的NH3为0.4 mol。
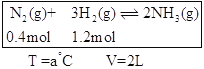
①判断该容器中的反应达平衡的依据是_______(填字母)。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(N2)不随时间改变
d.单位时间内生成2 mol NH3的同时消耗1 mol N2
e.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下容器中反应的平衡常数K=___;平衡时,混合气体压强p平=____(用初始压强p0表示)。
(3)近期,两位希腊化学家提出了电解合成氨的新思路:采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如图:
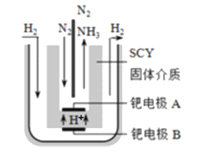
钯电极A是电解池的_____极(填“阳”或“阴”),阴极反应式为________________________________。
(4)合成氨需要纯净的氮气和氢气,在制取原料气的过程中,常混有一些杂质,其中的某些杂质会使合成氨的催化剂“中毒”,所以必须除去。例如,用稀氨水吸收H2S杂质:NH3·H2O + H2S![]()
![]() +HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
+HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学们通过以下实验探究乙醇的化学性质。

(1)乙醇的官能团是___(写名称)。
(2)实验Ⅰ中观察到的现象是___,有关反应的化学方程式是___。
(3)向实验Ⅱ的A试管内加入药品的先后顺序是___,加热后A试管内发生反应的化学方程式是___,该反应的类型是___。
(4)实验Ⅱ的B试管中盛放的液体是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com