
【题目】下列说法中正确的是( )
A.常温下,某溶液中由水电离出的![]() ,若
,若![]() ,则该溶液的
,则该溶液的![]()
B.常温下,某醋酸稀溶液![]() ,将此溶液稀释100倍后溶液的
,将此溶液稀释100倍后溶液的![]() ,则
,则![]()
C.等浓度的醋酸钠和盐酸按体积比2:1混合,则![]()
D.已知![]() 的
的![]() 为
为![]() ,则将等体积的
,则将等体积的![]() 的
的![]() 溶液和
溶液和![]() 溶液混合,会有
溶液混合,会有![]() 沉淀产生
沉淀产生
【答案】C
【解析】
A.水电离出的![]() ,若
,若![]() ,说明水的电离被抑制,该溶液为酸或碱溶液;
,说明水的电离被抑制,该溶液为酸或碱溶液;
B.醋酸为弱酸,稀释100倍后电离程度增大,溶液pH变化小于2个单位;
C.等浓度的醋酸钠和盐酸按体积比2:1混合,反应后溶质为醋酸钠、氯化钠和醋酸,结合电荷守恒、物料守恒分析;
D.计算溶液混合后的Qc,与Ksp比较大小后确定是否有沉淀生成。
![]() 某溶液中由水电离出的
某溶液中由水电离出的![]() ,若
,若![]() ,说明该溶液能抑制水的电离,可能是酸溶液或碱溶液,所以该溶液的pH值为a或
,说明该溶液能抑制水的电离,可能是酸溶液或碱溶液,所以该溶液的pH值为a或![]() ,故A错误;
,故A错误;
B.常温下,某醋酸稀溶液![]() ,将此溶液稀释100倍后,醋酸的电离程度增大,则稀释后溶液的pH变化小于2,溶液的
,将此溶液稀释100倍后,醋酸的电离程度增大,则稀释后溶液的pH变化小于2,溶液的![]() ,则
,则![]() ,故B错误;
,故B错误;
C.等浓度的醋酸钠和盐酸按体积比2:1混合,反应后溶质为![]() 、
、![]() 、NaCl,根据电荷守恒可得:
、NaCl,根据电荷守恒可得:![]() ,根据物料守恒可得:
,根据物料守恒可得:![]() ,结合
,结合![]() 可得:
可得:![]() ,故C正确;
,故C正确;
D.将等体积的![]() 的
的![]() 溶液和
溶液和![]() 溶液混合,Qc=(
溶液混合,Qc=(![]() ×10-4mol/L)2×
×10-4mol/L)2×![]() ×10-4mol/L=1.25×10-13<Ksp=1.12×10-12,说明溶液中不会生成
×10-4mol/L=1.25×10-13<Ksp=1.12×10-12,说明溶液中不会生成![]() 沉淀,故D错误;
沉淀,故D错误;
故选:C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )
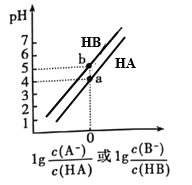
A. a点时,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1
B. 电离平衡常数:Ka(HA)< Ka(HB)
C. b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D. 向HB溶液中滴加NaOH溶液至pH=7时:c(B-)> c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
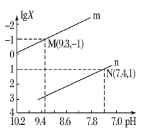
A.曲线m表示pH与lg![]() 的变化关系
的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.Ka1(H2CO3)=1.0×10-7.4
D.25℃时,CO32-+H2OHCO3-+OH-的水解常数为1.0×10-3.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
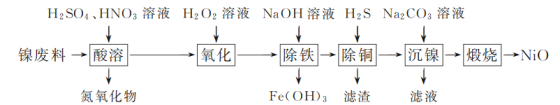
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,下列有关电解质溶液说法正确的是
时,下列有关电解质溶液说法正确的是![]()
![]()
A.稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大
B.向NaF溶液中滴加硫酸至中性时,![]()
C.向氨水中加入![]() 固体,溶液中
固体,溶液中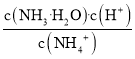 增大
增大
D.AgCl在水和NaCl溶液中的溶度积分别为![]() 、
、![]() ,则
,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外实验小组利用压强传感器、数据采集器和计算机等数字化实验设备,探究用0.01g镁条分别与2mL不同浓度稀盐酸的反应速率。实验结果如图所示。
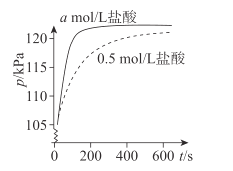
(1)Mg与盐酸反应的离子方程式是________。
(2)从微粒角度分析,该实验是为了探究________(因素)对该反应的化学反应速率的影响。
(3)a________0.5(填“>”或“<”)。
(4)如果用0.5mol/L硫酸代替上述实验中的0.5mol/L盐酸,二者的反应速率是否相同____,请说明原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。试回答:
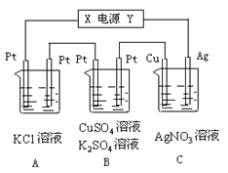
(1)电源电极X名称为_________(填“正极”或“负极”)
(2)烧杯中溶液的 pH变化:(填“增大”、“减小”或“不变”)B池________________,C池________________。
(3)写出A池中所发生的电解反应方程式:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CH3COONa溶液里,加入下列物质使水解平衡向左移动,并且pH变大的是 ( )
A. 加入适量纯CH3COOH
B. 加入少量NaCl固体
C. 加入少量NaOH固体
D. 加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NA代表阿伏加德罗常数,1mol C4H10中含共价键数目为14NA
B.某反应的ΔH = -88kJmol-1,则正反应活化能一定小于88kJmol-1
C.已知某温度下,Kw = 1×10-13,若将pH =8的NaOH溶液与pH =5的H2SO4溶液混合保持温度不变,欲使混合溶液pH =7,则NaOH溶液与H2SO4溶液的体积比为11:9
D.将浓度为0.1molL-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变,![]() 始终保持增大
始终保持增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com