
°æƒø°øœ¬¡–Àµ∑®∑˚∫œ ¬ µµƒ «
A.«øÀ·”ΫøºÓ÷–∫ÕµŒ∂® ±ø…“‘—°”√º◊ª˘≥»ªÚ∑”Ù◊˜÷∏ 溡£ª«øºÓ”λıÀ·÷–∫ÕµŒ∂® ±”¶∏√—°”√∑”Ù◊˜÷∏ 溡
B.‘⁄5![]() µƒ
µƒ![]() »Ð“∫÷–º”»Î3mLµ»≈®∂»µƒNaCl»Ð“∫£¨”–∞◊…´≥¡µÌ≤˙…˙£¨‘Ÿº”»Î3mLµ»≈®∂»µƒ
»Ð“∫÷–º”»Î3mLµ»≈®∂»µƒNaCl»Ð“∫£¨”–∞◊…´≥¡µÌ≤˙…˙£¨‘Ÿº”»Î3mLµ»≈®∂»µƒ![]() »Ð“∫£¨»Ð“∫÷–”÷”–∫⁄…´≥¡µÌ…˙≥…£¨Àµ√˜
»Ð“∫£¨»Ð“∫÷–”÷”–∫⁄…´≥¡µÌ…˙≥…£¨Àµ√˜![]()
C.ŒÔ÷ µƒ¡ø≈®∂»æ˘Œ™![]() µƒ»ıÀ·HXº∞∆‰—ŒNaX»Ð“∫µ»Ãª˝ªÏ∫œ∫Û£∫
µƒ»ıÀ·HXº∞∆‰—ŒNaX»Ð“∫µ»Ãª˝ªÏ∫œ∫Û£∫![]()
![]()
D.“—÷™![]() £¨
£¨![]() °£‘⁄∫¨
°£‘⁄∫¨![]() °¢
°¢![]() ≈®∂»œýÕ¨µƒ»Ð“∫÷–µŒº”
≈®∂»œýÕ¨µƒ»Ð“∫÷–µŒº”![]() »Ð“∫ ±£¨ ◊œ»…˙≥…
»Ð“∫ ±£¨ ◊œ»…˙≥…![]() ≥¡µÌ
≥¡µÌ
°æ¥∞∏°øA
°æΩ‚Œˆ°ø
A.«øºÓ”λıÀ·÷–∫Õ…˙≥…«øºÓ»ıÀ·—Œ£¨ÀÆΩ‚≥ ºÓ–‘£¨‘ÚŒ™ºı–° µ—ÈŒÛ≤Ó£¨µŒ∂® ±£¨”¶∏√—°”√∑”Ù◊˜÷∏ 溡£¨π A’˝»∑£ª
B.‘⁄![]() µƒ
µƒ![]() »Ð“∫÷–º”»Î3mLµ»≈®∂»µƒNaCl»Ð“∫£¨”–∞◊…´≥¡µÌ≤˙…˙£¨‘Ÿº”»Î3mLµ»≈®∂»µƒ
»Ð“∫÷–º”»Î3mLµ»≈®∂»µƒNaCl»Ð“∫£¨”–∞◊…´≥¡µÌ≤˙…˙£¨‘Ÿº”»Î3mLµ»≈®∂»µƒ![]() »Ð“∫£¨”…”⁄œıÀ·“¯π˝¡ø£¨»Ð“∫÷–”÷”–∫⁄…´≥¡µÌ…˙≥…£¨«““ı—Ù¿Î◊”±»≤ªÕ¨≤ªƒÐ±»Ωœ»Ð∂»ª˝≥£ ˝£¨π B¥ÌŒÛ£ª
»Ð“∫£¨”…”⁄œıÀ·“¯π˝¡ø£¨»Ð“∫÷–”÷”–∫⁄…´≥¡µÌ…˙≥…£¨«““ı—Ù¿Î◊”±»≤ªÕ¨≤ªƒÐ±»Ωœ»Ð∂»ª˝≥£ ˝£¨π B¥ÌŒÛ£ª
C.ŒÔ÷ µƒ¡ø≈®∂»æ˘Œ™![]() µƒ»ıÀ·HXº∞∆‰—ŒNaXµ»Ãª˝ªÏ∫œ∫Û£¨»Ð“∫÷–¥Ê‘⁄ŒÔ¡œ ÿ∫„£∫
µƒ»ıÀ·HXº∞∆‰—ŒNaXµ»Ãª˝ªÏ∫œ∫Û£¨»Ð“∫÷–¥Ê‘⁄ŒÔ¡œ ÿ∫„£∫![]() £¨π C¥ÌŒÛ£ª
£¨π C¥ÌŒÛ£ª
D.µ±![]() °¢
°¢![]() ≈®∂»æ˘Œ™
≈®∂»æ˘Œ™![]() ±£¨AgCl»Ð“∫÷–
±£¨AgCl»Ð“∫÷–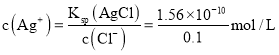 £¨
£¨![]() »Ð“∫÷–
»Ð“∫÷– £¨
£¨![]() ‘Ω–°£¨œ»…˙≥…≥¡µÌ£¨π AgClœ»≥ˆœ÷≥¡µÌ£¨π D¥ÌŒÛ£ª
‘Ω–°£¨œ»…˙≥…≥¡µÌ£¨π AgClœ»≥ˆœ÷≥¡µÌ£¨π D¥ÌŒÛ£ª
π —°A°£


 ÃÏÃϜڅœ“ª±æ∫√æÌœµ¡–¥∞∏
ÃÏÃϜڅœ“ª±æ∫√æÌœµ¡–¥∞∏ –°—ß…˙10∑÷÷””¶”√Âœµ¡–¥∞∏
–°—ß…˙10∑÷÷””¶”√Âœµ¡–¥∞∏
| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬√ÊÀƒ÷÷±‰ªØ÷–£¨”–“ª÷÷±‰ªØ”Î∆‰À˚»˝÷÷±‰ªØ¿ý–Õ≤ªÕ¨µƒ «£® £©
A.CH3CH2OH + CH3COOH ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
B.CH3CH2Br+NaOH ![]() CH2=CH2°¸+NaBr+H2O
CH2=CH2°¸+NaBr+H2O
C.2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D.CH3CH2OH + HBr°˙CH3CH2Br + H2O
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø‘™Àÿ÷Ð∆⁄±Ì «—ßœ∞ªØ—ßµƒ÷ÿ“™π§æþ£¨À¸“˛∫¨◊≈–Ì∂ý–≈œ¢∫Õπʬ…°£
I£Æ«Î∏˘æ𜬱Ì÷–∂Ã÷Ð∆⁄‘™Àÿµƒ‘≠◊”∞Îæ∂∫Õ÷˜“™ªØ∫œº€£¨ªÿ¥±Ì∫ÛŒ °£
¢Ÿ | ¢⁄ | ¢€ | ¢Ð | ¢ð | ¢Þ | ¢þ | ¢ý | |
‘≠◊”∞Îæ∂(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
◊Ó∏þªÚ◊ÓµÕªØ∫œº€ | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)‘™Àÿ¢Ÿ‘⁄÷Ð∆⁄±Ì÷–µƒŒª÷√Œ™________°£
(2)‘™Àÿ¢Ÿ°¢¢þµƒ«‚ªØŒÔµƒŒ»∂®–‘”…«øµΩ»ıµƒÀ≥–ÚŒ™_________(Ãѧ Ω)£ª
(3)‘™Àÿ¢Ÿ°¢¢€–Œ≥…µƒ18µÁ◊”ªØ∫œŒÔµƒµÁ◊” ΩŒ™______£ª
(4)‘™Àÿ¢⁄°¢¢ýµƒ◊Ó∏þº€—ıªØŒÔ∂‘”¶µƒÀƪ،Ô÷–£¨ºÓ–‘Ωœ«øµƒ «______(Ãѧ Ω)£ª
(5)‘™Àÿ¢ð°¢¢ýµƒ◊Ó∏þº€—ıªØŒÔ∂‘”¶µƒÀƪ،ԵƒÀƻГ∫∑¥”¶µƒ¿Î◊”∑Ω≥Ã ΩŒ™_________°£
II£Æ“‘œ¬√ø–°Ã‚÷–µƒµÁ≥ÿπ„∑∫ π”√”⁄»’≥£…˙ªÓ°¢…˙≤˙∫Õø∆—ߺº ıµ»∑Ω√Ê£¨«Î∏˘æðÂ÷–Ã·π©µƒ–≈œ¢£¨ÃÓ–¥ø’∏Ò°£
(6)«¶–ÓµÁ≥ÿ‘⁄∑≈µÁ ±∑¢…˙µƒµÁ≥ÿ∑¥”¶ ΩŒ™£∫Pb£´PbO2£´2H2SO4===2PbSO4£´2H2O°£«¶–ÓµÁ≥ÿ∑≈µÁ ±’˝º´ «__(ÃÓŒÔ÷ ªØ—ß Ω)°£»ÙµÁΩ‚“∫ê˝Œ™2L(
(7)º◊»©(HCHO)»º¡œµÁ≥ÿµƒπ§◊˜‘≠¿Ì»Áœ¬ÕºÀ˘ æ°£

¢Ÿ∏√µÁ≥ÿπ§◊˜ ±£¨bø⁄Õ®»ÎµƒŒÔ÷ Œ™________£ª
¢⁄∏√µÁ≥ÿπ§◊˜ ±£¨µÁ◊”µƒ¡˜œÚŒ™___________(ÃÓ°∞¥”◊ÛµΩ”“°±ªÚ°∞¥””“µΩ◊Û°±)£ª
¢€”“≤ýµÁº´µƒµÁº´∑¥”¶∑Ω≥Ã ΩŒ™___________°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–Œ“π˙ø∆ºº¥¥–¬µƒ≤˙∆∑…˱∏‘⁄π§◊˜ ±£¨ƒÐ¡ø◊™ªØπ˝≥ÔΗıªØªπ‘≠∑¥”¶”–πÿµƒ «£®°°°°£©
|
|
|
|
¢Ÿ≥§’˜»˝∫≈‘À‘ÿªº˝”√∆´∂˛º◊άŒ™»º¡œ | ¢⁄Êœ∂Àƒ∫≈‘¬«ÚÃΩ≤‚∆˜…œµƒÃ´—كеÁ≥ÿ∞ | ¢€∫Õ–≥∫≈∂Ø≥µ“‘350 km/h∑…≥€ | ¢Ð ¿ΩÁ ◊≤øø…’€µ˛»·∆¡ ÷ª˙Õ®ª∞ |
A.¢Ÿ¢⁄B.¢€¢ÐC.¢⁄¢€D.¢Ÿ¢Ð
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø»ÁÕº «ªØ—ßøŒÕ‚ªÓ∂Ø–°◊ȅ˺∆µƒ”√ªØ—ßµÁ‘¥£®–øÕ≠¡ÚÀ·‘≠µÁ≥ÿ£© πLEDµ∆∑¢π‚µƒ◊∞÷√ æ“‚Õº°£œ¬¡–”–πÿ∏√◊∞÷√µƒÀµ∑®’˝»∑µƒ «£® £©

A.Õ≠∆¨Œ™∏∫º´B.–ø∆¨…œ∑¢…˙ªπ‘≠∑¥”¶
C.∆‰ƒÐ¡ø◊™ªØµƒ–Œ Ω÷˜“™ «°∞ªØ—߃а˙µÁƒÐ°˙π‚ƒÐ°±D.»Áπ˚Ω´œ°¡ÚÀ·ªª≥…—ŒÀ·£¨LEDµ∆Ω´≤ªª·∑¢π‚
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øŒ¨…˙ÀÿCµƒΩ·ππºÚ Ω»ÁÕºÀ˘ æ£∫

¢≈Œ¨…˙ÀÿC∑÷◊”÷–°™OH‘≠◊”Õ≈µƒ√˚≥∆ «__________________£ªŒ¨…˙ÀÿC__________________»Ð”⁄ÀÆ(ÃÓ°∞“◊°±ªÚ°∞ƒ—°±)£¨ Ù”⁄________________ Œ¨…˙Àÿ£®ÃÓ°∞÷¨»Ð–‘°±ªÚ°∞ÀƻЖ‘°±£©°£
¢∆Œ¨…˙ÀÿC”÷±ª≥∆Œ™ø𪵗™À·£¨À¸ƒÐ¥ŸΩ¯Ω∫‘≠µ∞∞◊–Œ≥…£¨À˘“‘ƒÐ∑¿÷Œ_____________
¢«“ª∏ˆ»À√øÃÏ…„»Î‘º100mgŒ¨…˙ÀÿCæՃЬ˙◊„–Ë“™£¨œ¬¡–ŒÔ÷ ÷–∫¨”–∑·∏ªŒ¨…˙ÀÿCµƒ «____
A£Æøýπœ B£Æº¶µ∞ C£Æ∂π∏Ø D£Æ…≥∂°”„
¢»°∞∑˛”√Œ¨…˙ÀÿC£¨ø… π ≥ŒÔ÷–µƒ»˝º€Ã˙¿Î◊”ªπ‘≠≥…∂˛º€Ã˙¿Î◊”°±’‚扪∞Àµ√˜£∫Œ¨…˙ÀÿCæþ”–_____________–‘£®ÃÓ°∞—ıªØ–‘°±ªÚ°∞ªπ‘≠–‘°±£©£ªŒ¨…˙ÀÿC‘⁄’‚“ª∑¥”¶÷–∑¢…˙¡À_____________£®ÃÓ°∞—ıªØ∑¥”¶°±ªÚ°∞ªπ‘≠∑¥”¶°±£©°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø Ù”⁄º”≥…∑¥”¶µƒ «
A.CH2£ΩCH2 + Br2°˙CH2BrCH2Br
B.2CH3CH2OH +O2![]() 2CH3CHO + 2H2O
2CH3CHO + 2H2O
C.CH3CH2OH + 2Na °˙2CH3CH2ONa + H2°¸
D.CH4 + 2O2![]() CO2 + 2H2O
CO2 + 2H2O
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø‘⁄“ª∂®Œ¬∂»œ¬ƒ—»Ð—ŒAgClµƒ±•∫ջГ∫÷–£¨![]() ”Î
”Î![]() µƒŒÔ÷ µƒ¡ø≈®∂»¿ýÀ∆”⁄ÀÆ÷–
µƒŒÔ÷ µƒ¡ø≈®∂»¿ýÀ∆”⁄ÀÆ÷–![]() ∫Õ
∫Õ![]() µƒπÿœµ£¨º¥
µƒπÿœµ£¨º¥![]() ≥£ ˝£©£¨‘⁄œ¬¡–»Ð“∫÷–£∫
≥£ ˝£©£¨‘⁄œ¬¡–»Ð“∫÷–£∫
a.![]()
![]() »Ð“∫
»Ð“∫
b.![]()
![]() —ŒÀ·
—ŒÀ·
c.![]()
d.![]() »Ð“∫
»Ð“∫
‘ÚAgClµƒ»ÐΩ‚∂»”…¥ÛµΩ–°µƒÀ≥–ÚŒ™£® £©
A.abcdB.cbadC.dcabD.cbda
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø∞± «◊Ó÷ÿ“™µƒªØπ§‘≠¡œ÷Æ“ª£¨◊‘20 ¿ºÕ≥ı“‘¿¥£¨π§“µ…œ∫œ≥…∞±÷˜“™“¿¿µHaber-Boschºº ı°£ÃΩÀ˜–¬µƒ∫œ≥…∞±µƒ∑Ω∑®“ª÷± «÷ÿ“™øŒÃ‚°£
£®1£©◊Ó–¬µƒ°∞»Àπ§πõ™°±—–æø±®µ¿£∫‘⁄≥£Œ¬°¢≥£—π°¢π‚’’Ãıº˛œ¬£¨N2‘⁄¥þªØº¡±Ì√Ê”ÎÀÆ∑¢…˙∑¥”¶£¨÷±Ω”…˙≥…∞±∆¯∫Õ—ı∆¯°£
“—÷™£∫N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H = -a kJ/mol
H = -a kJ/mol
2H2(g) + O2(g) = 2H2O(1) ![]() H = -b kJ/mol
H = -b kJ/mol
–¥≥ˆ…œ ˆπõ™∑¥”¶µƒ»»ªØ—ß∑Ω≥Ã Ω£∫_______________°£
£®2£©∫„Œ¬°¢∫„»ðÃıº˛œ¬£¨‘⁄»ð∆˜÷–ƒ£ƒ‚Haber-Bosch∑®∫œ≥…∞±£¨»Áœ¬Õº(Õº÷–À˘ æ ˝æðŒ™≥ı ºŒÔ¿Ì¡ø)°£t∑÷÷”∫Û∑¥”¶¥ÔµΩ∆Ω∫‚£¨…˙≥…µƒNH3Œ™0.4 mol°£
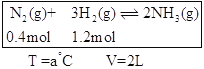
¢Ÿ≈–∂œ∏√»ð∆˜÷–µƒ∑¥”¶¥Ô∆Ω∫‚µƒ“¿æð «_______(ÃÓ◊÷ƒ∏)°£
a£Æ—π«ø≤ªÀÊ ±º‰∏ƒ±‰
b£Æ∆¯Ãµƒ√Ð∂»≤ªÀÊ ±º‰∏ƒ±‰
c£Æc(N2)≤ªÀÊ ±º‰∏ƒ±‰
d£Æµ•Œª ±º‰ƒ⁄…˙≥…2 mol NH3µƒÕ¨ ±œ˚∫ƒ1 mol N2
e£Æµ•Œª ±º‰ƒ⁄∂œ¡—3 mol H-Hº¸£¨Õ¨ ±∂œ¡—6 mol N-Hº¸
¢⁄∏√Ãıº˛œ¬»ð∆˜÷–∑¥”¶µƒ∆Ω∫‚≥£ ˝K£Ω___£ª∆Ω∫‚ ±£¨ªÏ∫œ∆¯Ã—π«øp∆Ω=____(”√≥ı º—π«øp0±Ì æ)°£
£®3£©Ω¸∆⁄£¨¡ΩŒªœ£¿∞ªØ—ߺ“÷≥ˆ¡ÀµÁΩ‚∫œ≥…∞±µƒ–¬Àº¬∑£∫≤…”√∏þ÷ ◊”µºµÁ–‘µƒSCYÃ’¥…(ƒÐ¥´µðH+)Œ™ΩÈ÷ £¨ µœ÷¡À∏þŒ¬(570°Ê)≥£—πœ¬∏þ◊™ªØ¬ µƒµÁΩ‚∑®∫œ≥…∞±£¨◊™ªØ¬ ø…¥ÔµΩ78£•£¨◊∞÷√»ÁÕº£∫
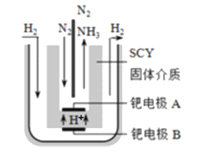
ÓŸµÁº´A «µÁΩ‚≥ÿµƒ_____º´(ÃÓ°∞—Ù°±ªÚ°∞“ı°±)£¨“ıº´∑¥”¶ ΩŒ™________________________________°£
£®4£©∫œ≥…∞±–Ë“™¥ø檵ƒµ™∆¯∫Õ«‚∆¯£¨‘⁄÷∆»°‘≠¡œ∆¯µƒπ˝≥Ã÷–£¨≥£ªÏ”–“ª–©‘”÷ £¨∆‰÷–µƒƒ≥–©‘”÷ ª· π∫œ≥…∞±µƒ¥þªØº¡°∞÷–∂æ°±£¨À˘“‘±ÿ–Î≥˝»•°£¿˝»Á£¨”√œ°∞±ÀÆŒ¸ ’H2S‘”÷ £∫NH3°§H2O + H2S![]()
![]() +HS£≠+ H2O£¨»ÙΩ´±Íøˆœ¬22.4L H2SÕ®»Î1L 1mol/L NH3°§H2O÷–Ω¯––Œ¸ ’£¨‘Ú¥ÔµΩ∆Ω∫‚ ±£¨H2SµƒŒ¸ ’–߬ Œ™_________%£®Ω·π˚±£¡Ù¡ΩŒª”––ß ˝◊÷£©°££®◊¢£∫Œ¸ ’–߬ =c(H2S)“—∑¥”¶/c(H2S)◊У©£®“—÷™≥£Œ¬œ¬NH3°§H2OµƒµÁ¿Î∆Ω∫‚≥£ ˝Kb=2°¡10-5£¨H2SµƒµÁ¿Î∆Ω∫‚≥£ ˝Ka1 = 5°¡10-8£¨Ka2 = 7.1°¡10-15£©
+HS£≠+ H2O£¨»ÙΩ´±Íøˆœ¬22.4L H2SÕ®»Î1L 1mol/L NH3°§H2O÷–Ω¯––Œ¸ ’£¨‘Ú¥ÔµΩ∆Ω∫‚ ±£¨H2SµƒŒ¸ ’–߬ Œ™_________%£®Ω·π˚±£¡Ù¡ΩŒª”––ß ˝◊÷£©°££®◊¢£∫Œ¸ ’–߬ =c(H2S)“—∑¥”¶/c(H2S)◊У©£®“—÷™≥£Œ¬œ¬NH3°§H2OµƒµÁ¿Î∆Ω∫‚≥£ ˝Kb=2°¡10-5£¨H2SµƒµÁ¿Î∆Ω∫‚≥£ ˝Ka1 = 5°¡10-8£¨Ka2 = 7.1°¡10-15£©
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
π˙º —ß–£”≈—° - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com