
【题目】常温下,下列各组离子在指定溶夜中一定能大量共存的是( )
A.在酸性溶夜中: ![]()
B.饱和氯水中:![]()
C.在水溶夜中:![]()
D.pH=0的溶液中:![]()
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2 mL 0.1mol/L的FeCl3溶液中加足量铁粉,振荡,加2滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 在稀AgNO3溶液中先加入足量0.1mol/L NaCl溶液,再加入少量0.1mol/L NaI溶液 | 先产生白色沉淀,后出现黄色沉淀 | 说明Ksp(AgCl)>Ksp(AgI) |
C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 常温下,测定等物质的量浓度的Na2CO3和Na2SO4溶液的pH值 | 前者的 pH值比后者的大 | 非金属性:S>C |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期,柔性屏手机开始崭露头角。某柔性屏手机的柔性电池以碳纳米管做电极材料,以ZnSO4溶液的有机高聚物为固态电解质,其电池总反应为:MnO2+![]() Zn +(1+
Zn +(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4·3Zn(OH)2·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。
ZnSO4·3Zn(OH)2·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。

下列说法中,正确的是
A.充电时,含有锌膜的碳纳米管纤维一端连接电源正极
B.放电时,电池的正极反应为:MnO2 + e- + H+ = MnOOH
C.充电时,Zn2+移向Zn膜
D.有机高聚物中的氢键是一种特殊的化学键,键能大于共价键,能使高聚物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络图片“一脸辛酸”中,出现了有机物辛酸(分子式:C8H16O2,键线式:![]() )。辛酸天然品存在于肉豆蔻、柠檬草、苹果、椰子油、葡萄酒、酒花等中,稀释后呈现水果香气。下列说法中正确的是
)。辛酸天然品存在于肉豆蔻、柠檬草、苹果、椰子油、葡萄酒、酒花等中,稀释后呈现水果香气。下列说法中正确的是

A.只要含碳的化合物就是有机物
B.辛酸属于烷烃
C.有机物只溶于有机溶剂,不溶于水,所以辛酸不溶于水
D.许多有机物不仅存在于生物体内,也可以人工合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜, 主要作用是在反应过程中只让Li+通过。结构如图所示。
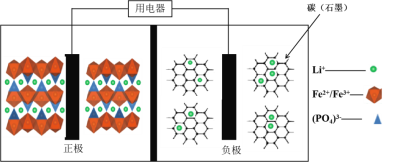
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A. 放电时,正极电极反应式:xFePO4+xLi++xe-===xLiFePO4
B. 放电时,电子由负极经导线、用电器、导线到正极
C. 充电时,阴极电极反应式:xLi++xe-+nC===LixCn
D. 充电时,Li+向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,研读下图,下列判断不正确的是
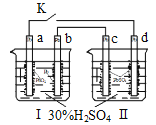
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol
C.K闭合时,II中SO42-向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:
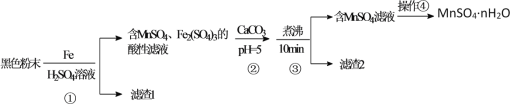
下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH>4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.2000mol/LNaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和
D.室温下,将CH3COONa溶液加水稀释,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电离常数的负对数pK=-lgK,25℃时,HX的pKa=4.76,H2Y的pKa1=1.22,pKa2=4.19,下列说法正确的是( )
A.浓度相等的NH4X和NH4HY溶液中c(NH4+):前者大于后者
B.NaX溶液中滴加KHY溶液至pH=4.76:c(K+)+c(Na+)>c(HY-)+2c(Y2-)+c(X-)
C.KHY溶液中滴加氨水至中性:c(NH4+)>c(Y2-)
D.K2Y溶液中滴加盐酸至pH=1.22:c(Cl-)-3c(HY-)=c(H+)-c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com