
����Ŀ����ͼ��Ԫ�����ڱ��IJ��ֿ�ܣ���ش�

��1������Ԫ�����ڱ��ش��������⣺
��a��д��Ԫ�آ������ڱ��е�λ��___________��Ԫ�آߺ�Ԫ�آ������������ˮ���������Խ�ǿ��___________���û�ѧʽ��ʾ����
��b��Ԫ�آ���Ԫ�آ��γɵĻ���������___________������ۡ������ӡ�����ͬ�������Ԫ�آ���Ԫ�آ��γɵĻ���������___________�����
��c����д��Ԫ�آڵ�ԭ�ӽṹʾ��ͼΪ___________��Ԫ�آڵ����������ṹʽΪ��___________��Ԫ�آ٩����е�ij�����ڳ����»�ѧ�����ȶ���ͨ�������������������õ���ʽ��ʾ�����___________��
��2��Ԫ�����ڱ���λ��б�Խ��ߵ�����Ԫ�ؼ�������ʮ�����ƣ���֮Ϊ�Խ��߷�����Ԫ�����ڱ��Խ��߷������루Be���������ʼ��仯��������ʮ�����ƣ�
��a��д��֤��Al2O3���������ʵĻ�ѧ��Ӧ�����ӷ���ʽ��___________��___________��
��b�����й�������ж���ȷ����__________
A��������Ļ�ѧʽΪBe2O3 B��Be��OH��2������ˮ
C��BeCl2�����ӻ����� D��Be��OH��2��������
��c��Be��OH��2��Mg��OH��2�����Լ�___________����
���𰸡��������ڵ�IVA�� H2SO4 ���� ���� ![]() O=C=O
O=C=O ![]() Al2O3+6H+=2Al3++3H2O Al2O3+2OH��=2AlO2��+H2O D ����������Һ
Al2O3+6H+=2Al3++3H2O Al2O3+2OH��=2AlO2��+H2O D ����������Һ
��������
����Ԫ�������ڱ��е����λ�ÿ�֪�١���ֱ���H��C��N��O��Mg��Si��P��S��Cl����
��1����a��Ԫ�آ���Si�������ڱ��е�λ���ǵ������ڵ�IVA�壻�ǽ�����P��S����Ԫ�آߺ�Ԫ�آ������������ˮ���������Խ�ǿ��H2SO4����b��Ԫ�آ���Ԫ�آ��γɵĻ����������Ȼ�̼�����ڹ��ۻ����Ԫ�آ���Ԫ�آ��γɵĻ��������Ȼ�þ���������ӻ������c��̼Ԫ�ص�ԭ�ӽṹʾ��ͼΪ![]() ��Ԫ�آڵ�����������Ƕ�����̼���ṹʽΪO=C=O�������ڳ����»�ѧ�����ȶ���ͨ��������������������ʽΪ
��Ԫ�آڵ�����������Ƕ�����̼���ṹʽΪO=C=O�������ڳ����»�ѧ�����ȶ���ͨ��������������������ʽΪ![]() ����2����a��֤��Al2O3���������ʵĻ�ѧ��Ӧ�����ӷ���ʽ�ֱ���Al2O3+6H+=2Al3++3H2O��Al2O3+2OH��=2AlO2��+H2O����b��A��������Ļ�ѧʽΪBeO��A����B�������������ܣ�Be��OH��2������ˮ��B����C���Ȼ����ǹ��ۻ����BeCl2�ǹ��ۻ����C����D�����������������������Be��OH��2�������ԣ�D��ȷ����ѡD����c��Be��OH��2�������ԣ����Be��OH��2��Mg��OH��2��������������Һ����
����2����a��֤��Al2O3���������ʵĻ�ѧ��Ӧ�����ӷ���ʽ�ֱ���Al2O3+6H+=2Al3++3H2O��Al2O3+2OH��=2AlO2��+H2O����b��A��������Ļ�ѧʽΪBeO��A����B�������������ܣ�Be��OH��2������ˮ��B����C���Ȼ����ǹ��ۻ����BeCl2�ǹ��ۻ����C����D�����������������������Be��OH��2�������ԣ�D��ȷ����ѡD����c��Be��OH��2�������ԣ����Be��OH��2��Mg��OH��2��������������Һ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ֤��ϡ������ͭ��Ӧ����������ΪNO���������ͼʵ��(ʵ������л���2Ϊ��״̬)������˵���в���ȷ����
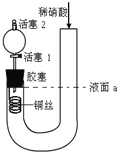
A. �رջ���1������ϡ������Һ��a��
B. ��װ������Լ��ȿ��Լ���ͭ���ܽ�
C. ͨ���رջ�������1���Կ��Ʒ�Ӧ�Ľ���
D. ��Ӧ��ʼ�����·�����ɫ�������ɣ�������֤��������ΪNO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʰ�����������Ρ��������˳����ϵ�һ��Ϊ�� ����
A.���ᡢ�������Ȼ��ơ���ʯ��B.����ˮ����ˮ��̼�����ơ���������
C.���������ᡢ����ɱ�D.���ᡢˮú�����Ȼ�ͭ��Һ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ӷ���ʽ�����ӹ����������ȷ����
A. �������������������� Fe3O4�� 8H��= 2Fe3��+ Fe2�� + 4H2O
B. �÷���(��Ҫ�ɷ�C17H35COONa)���麬�н϶�����ӵ�Ӳˮ��2C17H35COO��+Ca2+=(C17H35COO)2Ca��
C. �����£���![]() =0.1����Һ�У�Na����K����AlO2����HCO3���ܴ�������
=0.1����Һ�У�Na����K����AlO2����HCO3���ܴ�������
D. ��NaClO��Һ�У�SO32����OH����Cl����K��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��Cl-Ũ������ ( ��
A.200mL 2mol/L MgCl2��ҺB.1000mL 2.5mol/L NaCl��Һ
C.250mL 1mol/L AlCl3��ҺD.200mL 4.5mol/L KClO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�����ڱ���Ԫ�������ɣ��ж�������������ȷ����

A. ��̬�⻯����ȶ��ԣ�H2O��NH3��SiH4
B. ��Ԫ��������Ԫ�ؿ��γɹ��ۻ���������ӻ�����
C. ��ͼ��ʾʵ���֤��Ԫ�صķǽ����ԣ�Cl��C��Si
D. ��������![]() ������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
������o�������ĵ�118��Ԫ�������ڱ���λ�ڵ�������0��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��RԪ�ص�ԭ�ӣ���������p�ܼ��������������е��ܲ�s�ܼ�������������R������
A. Li B. Be C. S D. Ar
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W����ԭ������������������ֶ���������Ԫ�أ�����������������������Ԫ�����ڱ��У�Z��Y��W�����ڣ���X��Y��W�ֱ�λ�ڲ�ͬ���ڣ���Y��Z��W����Ԫ�ص�ԭ������������֮��Ϊ17������˵���������
A. X��Y��Z�����γ����ӻ���������γɹ��ۻ�����
B. Y��ZԪ�ص�ԭ�Ӱ뾶��С˳��ΪY>Z
C. X��Y��Z֮���γɵĺ����������Ϊ10����ֻ��YX3��X2Z
D. Z��WԪ�ص�����⻯��ķе���ȶ��Ծ�ΪH2Z>H2W
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com