
【题目】已知某无色透明溶液中仅含有包括Na+和CH3COO-在内的四种离子。
请回答下列问题。
(1)该溶液中的溶质可能有三种情况,请分别写出各种情况的化学式:
①_____________________;②________________________;③____________________ 。
(2)25℃,若由0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合,测得混合溶液的pH=8,则c(CH3COOH)+c(H+)的精确值为___________________mol/L。
(3)若该溶液的pH=8,则c(Na+)-c(CH3COO-)的精确值为___________________mol/L。
(4)当溶液中各离子浓度大小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,则该溶液可能是____(填序号);
A.由0.1 mol/L的CH3COONa溶液与0.1 mol/L的CH3COOH溶液等体积混合而成
B.由0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合而成
C.由0.2 mol/L的CH3COONa溶液与0.1 mol/L的HCl溶液等体积混合而成
D.由0.2 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合而成
(5)常温下,将a mol/L的CH3COOH溶液与0.01 mol/L的NaOH溶液等体积混合,反应平衡后溶液中c(Na+)=c(CH3COO-),用含a的代数式表示CH3COOH的电离平衡常数Ka=_________。
【答案】CH3COONa CH3COONa和CH3COOH CH3COONa和NaOH 1×10-6 9.9×10-7 AD 1×10-9/(a-0.01)
【解析】
本题考查离子浓度的大小比较以及弱电解质的电离平衡常数的相关计算等问题,题目难度较大,注意根据溶液离子浓度的关系结合弱电解质的电离等知识解答。
(1)能电离出醋酸根离子的物质可以是醋酸和醋酸钠,能电离出钠离子的物质可以是氢氧化钠和醋酸钠,所以当溶液中含有Na+和CH3COO-在以及OH-、H+时,溶液中溶质的组成可以是:①CH3COONa、CH3COONa和CH3COOH、CH3COONa和NaOH,
故答案为:CH3COONa;CH3COONa和CH3COOH;CH3COONa和NaOH。
(2)25℃,若由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH=8,由质子守恒可知:c(CH3COOH)+c(H+)=c(OH-)=1×10-6,
故答案为:1×10-6。
(3)溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=106 mol/L - 108mol/L =(10-6-10-8)mol/Lmol/L=9.9×10-7mol/L,
故答案为:9.9×10-7。
(4)A.等浓度的CH3COONa和醋酸混合溶液中,醋酸的电离程度大于醋酸根离子的水解程度,所以离子的浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故符合;
B.醋酸钠溶液中,钠离子浓度大于醋酸根浓度,故不符合;
C.由0.2mol/L的CH3COONa溶液与0.1mol/L的HCl溶液等体积混合而成,得到物质的量浓度相等的醋酸、醋酸钠和氯化钠,钠离子浓度大于醋酸根浓度,故不符合;
D.由0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成,得到等物质的量浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解程度,所以离子的浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故符合;
故选:AD。
(5)常温下,将a mol/L的CH3COOH溶液与0.01mol/L的NaOH溶液等体积混合,反应平衡后溶液中c(Na+)=c(CH3COO-),根据电荷守恒得c(OH-)=c(H+),溶液呈中性,又电离平衡常数![]() ,c(H+)=10-7mol/L,c(Na+)=c(CH3COO-)=0.005mol/L,c(CH3COOH)=
,c(H+)=10-7mol/L,c(Na+)=c(CH3COO-)=0.005mol/L,c(CH3COOH)=![]() mol/L,则Ka=
mol/L,则Ka=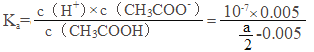 =1×10-9/(a-0.01)
=1×10-9/(a-0.01)
故答案为:1×10-9/(a-0.01)。


科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,它们的原子最外层电子数总和等于Z的原子序数,由这四种元素组成一种化合物M具有如下性质下列推断正确的是

A. 原子半径:Z>Y>X>W
B. 最高价氧化物对应的水化物酸性:Y>X
C. 简单阴离子的还原性:W<Z
D. W、Y、Z组成的化合物只含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol·Lˉ1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是( )

A. HX为弱酸
B. M点c(HX)—c(X-)﹥c(OH-)—c(H+)
C. 将P点和N点的溶液混合,呈酸性
D. 向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX)=c(Cl-) >c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种叶绿素分子(左)和血红蛋白分子(右)的局部结构简图,下列说法不正确的是( )

A.合成叶绿素和血红蛋白分别需要镁和铁
B.植物体缺氮会影响光合作用
C.人体缺铁会影响血红蛋白对氧的运输
D.Mg和Fe分别存在于植物和动物细胞中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知存在离子反应3S+6OH-=2S2-+SO32-+3H2O,关于该反应的说法正确的是
A. 该反应属于复分解反应
B. 该反应氢氧根离子作氧化剂
C. 该反应中氧化剂与还原剂的质量为2∶1
D. 每生成2个S2-反应转移的电子数为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】见下图(A)处通入Cl2,当关闭(B)阀时,(C)处的湿润的红布条没有明显变化,当打开(B)阀时,(C)处的湿润红布条逐渐褪色,则(D)瓶中装的溶液是

A. 浓硫酸B. NaOH溶液C. 水D. NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国新型火箭长征5号采用液氢和液氧作为推进剂。有关说法不正确的是( )
A.将氢、氧液化可增加火箭携带燃料总量
B.火箭依靠氢气和氧气燃烧放出的热推进
C.拆开氢、氧分子中的化学键需要吸收能量
D.燃料的总能量小于燃烧产物水的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g H2完全燃烧生成水蒸气放出热量121 kJ,且O2中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中形成1 mol H—O键时放出热量463 kJ,则H2中1 mol H—H键断裂时吸收的热量为
A. 188 kJB. 557 kJC. 920 kJD. 436 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com