
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题:
(1)基态Co原子核外电子占据_________种不同的能级,其中有__________个未成对电子。
(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ键的数目为_____________________。
②与CNO-互为等电子体的分子为_______________(填化学式,任写一种)
③C、N、O三种基态原子的第一电离能由大到小的顺序为___________(用元素符号表示)。
④相同压强下,CO晶体的熔点高于N2晶体的原因为____________________________。
(3)多硼酸根的结构之一为链状(如图1),化学式为______________,其中B原子的杂化形式为______________。

(4)BN晶体有多种结构,其中立方氮化硼具有金刚石型结构(如图2)。
①晶体的最小环中含有____________个B原子。
②若晶胞参数为anm,晶胞密度为ρg·cm-3,则阿伏加德罗常数的值可表示为_____________。
【答案】 7 3 18NA(或18×6.02×1023等合理答案即可) CO2或CS2或N2O等合理答案 N>O>C CO为极性分子,N2非极性分子,CO分子间的范德华力更大 BO2-或(BO2)nn- Sp2 3 ![]()
【解析】(1)基态Co核外电子排布为1s22s22p63s23p63d74s2,原子核外电子占据1s、2s、2p、3s、3p、3d、4s共7种不同的能级,其中有3个未成对电子。(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ键的数目为3×6×6.02×1023=18×6.02×1023。②与CNO-互为等电子体的分子为CO2或CS2或N2O等合理答案;③同一周期从左到右第一电离能逐渐增大,N中P电子处于半充满状态,第一电离能变大,C、N、O三种基态原子的第一电离能由大到小的顺序为 N>O>C(用元素符号表示)。④相同压强下,CO晶体的熔点高于N2晶体的原因为 CO为极性分子,N2非极性分子,CO分子间的范德华力更大。(3)多硼酸根化学式为 BO2-或(BO2)nn-,其中B原子形成2个σ键,最外层3个电子,又得一个,共4个价电子,形成σ键用去2个,有一个孤电子对,杂化形式为 Sp2 。(4)①晶体的最小环中含有3个B原子,3个N原子,形成6元环;立方氮化硼中,晶胞边长为a cm,晶胞体积V=(acm)3,该晶胞中N原子个数=8×1/8+6×1/2=4、B原子个数为4,立方氮化硼的密度ρ=4M/(NAV)=4×25/NA×(a×10-7cm) 3g·cm-3=100/(a×10-7cm)3NAg·cm-3,NA=1023/ρa3.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,pH=l 的某溶液 A 中除H+外,还含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、 Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol·L-1。现取该溶液进行有关实验,实验结果如下图所示,下列有关说法正确的是

A. 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B. 实物消耗Cu14.4g,则生成气体丁的体积为3.36L
C. 该溶液一定没有Fe3+,但是无法确定是否含有I-
D. 沉淀乙一定有BaCO3,可能有BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒后驾车是马路上的第一大杀手。已知酒精(C2H5OH)能与K2Cr2O7和H2SO4的混合溶液在一定条件下发生如下反应:2K2Cr2O7+3C2H5OH+8H2SO4 2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,且知Cr2O72-和Cr3+在溶液中分别显橙色和绿色,回答下列问题:
(1)该反应________(填“是”或“不是”)离子反应。
(2)写出Cr2(SO4)3的电离方程式:______________________________________。
(3)该反应________(填“是”或“不是”)氧化还原反应,判断的依据是_________________________________。
(4)你认为能否用这一反应来检测司机是否酒后驾车?________(填“能”或“不能” ),简述其原理________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个体积相同的容器,一个盛有NO,另外一个盛有N2和O2,在标准状况下两容器内的气体一定具有相同的( )
①原子总数;②质子总数;③分子总数;④质量
A.①②B.②④C.②③D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,甲、乙两池中均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始时先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流表指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )

A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液浓度上升
C. 断开K1,闭合K2后,A电极发生氧化反应
D. 断开K1,闭合K2后,NO![]() 向B电极移动
向B电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有许多重要的化合物,除中学化学常见的三种氧化物和两种氢氧化物外,还有许多盐。FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子Cr2O![]() )进行处理。
)进行处理。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:
________________________________________________________________________。
(2)试配平:________Fe2++________Cr2O![]() +________===________Fe3++________Cr3++________H2O
+________===________Fe3++________Cr3++________H2O
(3)若该废水经处理后Cr3+的含量为1×10-2 mol·m-3,理论上83.4 kg绿矾可以处理该废水________吨(已知废水的密度为1 g·cm-3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物遗传信息的携带者和生命活动的主要承担者分别是( )
①核酸 ②核糖核酸 ③脱氧核糖核酸 ④蛋白质 ⑤脂质 ⑥糖类
A. ①④ B. ②⑤ C. ③⑥ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
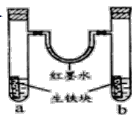
【题目】下图装置中,U型管内为红墨水,a,b试管内分别盛有食盐水和氯化铁溶液。各加入生铁块放置一段时间。下列有关描述错误的是( )
A. 生铁比纯铁更易被腐蚀
B. 红墨水柱两边的液面变为左高右低
C. 两试管中相同的电极反应式是:Fe-2e-→Fe2+
D. a试管中发生了吸氧腐蚀,正极反应式为O2+4e-+4H+=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com