
【题目】“常见无机物”,主要是指的铝、铁、硫、氯四种元素的单质及化合物。完成下列填空:
(1)四种元素原子的半径大小Fe>__>__>__。
(2)铝原子核外电子排布式___,有___种不同能量的电子。
(3)若铝热剂的成分是铝粉与氧化铁的混合物,写出该铝热反应的化学方程式__,并标明该反应的电子转移方向和数目。
(4)工业上用氯气和___制取得到漂粉精,其有效成分是___(写化学式)。
(5)硫的非金属性___于氯(选填“强”、“弱”),请用一个事实证明___,再从原子结构的角度加以解释___。
【答案】Al S Cl 1s22s22p63s23p1 5  Ca(OH)2 Ca(ClO)2 弱 氯气通入硫化钠溶液中有淡黄色沉淀生成 Cl原子与S原子电子层结构相同,最外层电子数Cl>S,原子半径S>Cl,因此在反应中Cl原子比S原子更容易得到电子达到稳定结构,所以即非金属性Cl比S强
Ca(OH)2 Ca(ClO)2 弱 氯气通入硫化钠溶液中有淡黄色沉淀生成 Cl原子与S原子电子层结构相同,最外层电子数Cl>S,原子半径S>Cl,因此在反应中Cl原子比S原子更容易得到电子达到稳定结构,所以即非金属性Cl比S强
【解析】
(1)同周期,从左向右,原子半径逐渐减小;
(2)Al原子为13号元素,核外有三个电子层;有几个能级,就有几种不同能量的电子;
(3)铝和氧化铁反应生成氧化铝和铁,Al为还原剂,氧化铁为氧化剂;
(4)工业上用氯气和Ca(OH)2反应来制取漂白精;
(5)同周期从左向右非金属性逐渐增强;从置换反应来判断非金属性强弱;从原子结构的特点思考,Cl与S分别位于第三周期的第VIIA族和第VIA族,原子半径S>Cl,Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即非金属性Cl比S强。
(1)Al、S、Cl三种元素均位于第三周期,同周期,从左向右,原子半径逐渐减小,因此原子半径的大小关系为:Al>S>Cl;
(2)Al原子的核外电子排布式为:1s22s22p63s23p1,有1s、2s、2p、3s、3p共5种不同能量的电子;
(3)铝和氧化铁反应生成氧化铝和铁,反应方程式为:2Al+Fe2O3![]() Al2O3+2Fe,反应中Al失去电子,发生氧化反应,Fe得到电子,发生还原反应,2molAl参与反应,电子转移6mol,用单线桥表示电子转移方向和数目为:
Al2O3+2Fe,反应中Al失去电子,发生氧化反应,Fe得到电子,发生还原反应,2molAl参与反应,电子转移6mol,用单线桥表示电子转移方向和数目为: ;
;
(4)工业上用氯气和Ca(OH)2反应来制取漂白精,漂白精的主要成分是Ca(ClO)2;
(5)同周期从左向右非金属性逐渐增强,因此硫的非金属性弱于氯,可用置换反应来判断非金属性强弱,即Cl2可从Na2S溶液中置换出S,反应方程式为Na2S+Cl2=2NaCl+S↓,可看到淡黄色沉淀生成;从两原子的原子结构可知,Cl与S分别位于第三周期的第VIIA族和第VIA族,电子层结构相同,最外层电子数Cl>S,原子半径S>Cl,因此在反应中Cl原子比S原子更容易得到电子达到稳定结构,所以即非金属性Cl比S强。


科目:高中化学 来源: 题型:
【题目】钒(V)、 锰(Mn)、铁(Fe)、 砷(As)、硒(Se)均为第四周期的元素,完成下列问题。
(1)钒有+2、+3、+4、+5等几种化合价。这几种价态中,最稳定的是______。
(2)基态Fe2+的价层电子的轨道表示式为________,检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下:
Mn:![]() =717kJ/mol ,
=717kJ/mol ,![]() =1509kJ/mol ,
=1509kJ/mol ,![]() =3248kJ/mol ,
=3248kJ/mol ,
Fe:![]() =759kJ/mol,
=759kJ/mol,![]() =1562kJ/mol ,
=1562kJ/mol ,![]() =2957kJ/mol ,
=2957kJ/mol ,
根据数据可知,气态Mn2+ 再失去一个电子比气态Fe2+ 再失去一个电子难,其原因是____________________。
(4)沸点:NH3__________AsH3(填“>”、“<”或“=”),原因是_____________________。
(5)H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3 酸性强的原因___________________________________ 。
(6)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
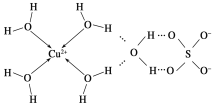
胆矾的化学式用配合物的形式表示为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲是某学生验证铜和浓硝酸反应的装置,乙、丙是另外两位同学对甲装置改进后的装置:

(1)甲、乙、丙三个装置中都发生的反应的化学方程式:__。
(2)和甲装置相比,乙装置的优点是
①__;
②__。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。实验时先关闭止水夹__,再打开止水夹__,才能使NO2气体充满②试管;当气体充满②试管后,将铜丝提起与溶液脱离。欲使烧杯中的水进入②试管,应该__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2 通入 BaCl2 溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧 Y 形管中放置的药品组合符合要求的是( )
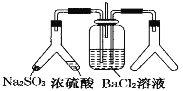
①Cu 和浓硝酸 ②氢氧化钠固体和浓氨水 ③大理石和稀盐酸 ④过氧化氢和二氧化锰
A. ①②④B. 全部C. ②③D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
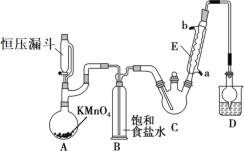
【题目】三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②相关物质的相对分子质量及部分物理性质:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
C2H5OH | 46 | -114.1 | 78.3 | 与水互溶 |
CCl3CHO | 147.5 | -57.5 | 97.8 | 可溶于水、乙醇 |
CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
C2H5Cl | 64.5 | -138.7 | 12.3 | 微溶于水,可溶于乙醇 |
(1)恒压漏斗中盛放的试剂的名称是_____,盛放KMnO4仪器的名称是_____。
(2)反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸),写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式:_____。
(3)该设计流程中存在一处缺陷是_____,导致引起的后果是_____,装置B的作用是______。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行_____(填是或否),原因是_____。
(5)测定产品纯度:称取产品0.36g配成待测溶液,加入0.1000molL1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000molL1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为_____(计算结果保留四位有效数字)。滴定原理:CCl3CHO+OH-=CHCl3+HCOO-、HCOO-+I2=H++2I-+CO2、I2+2S2O32-=2I-+S4O62-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A. 简单离子半径:b>e
B. 常温常压下,a与c形成的化合物可能呈固态
C. 单质沸点:c<d
D. d与e不能存在于同一离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据图回答下列问题:

(1)若烧杯中的溶液为稀硫酸,则观察到的现象是___________,负极反应式为___________。
(2)若烧杯中的溶液为氢氧化钠溶液,则正极反应为___________,总反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )
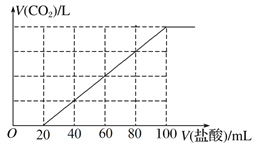
A. 通入CO2的物质的量为0.02 mol
B. 原NaOH溶液的浓度为0.12 mol·L-1
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com