
【题目】a、b、c、d、e五种短周期元素的原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A. 简单离子半径:b>e
B. 常温常压下,a与c形成的化合物可能呈固态
C. 单质沸点:c<d
D. d与e不能存在于同一离子化合物中
科目:高中化学 来源: 题型:
【题目】A~E 是中学常见的 5 种化合物,A、B 是氧化物,它们之间的转化关系如图所示。

则下列说法正确
A. 单质 Y 在一定条件下能与水发生置换反应
B. 检验 D 溶液中金属阳离子的反应:Fe3++3SCN-===Fe(SCN) 3↓
C. 单质 X 与 A 反应的化学方程式:Al2O3+2Fe![]() Fe2O3+2Al
Fe2O3+2Al
D. 由于化合物 B 和 C 均既能与酸反应,又能与碱反应,所以两者均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 生成乙烯的速率:v(N)一定大于v(M) B. 该反应的逆反应为吸热反应
C. 平衡常数:KM>KN D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨(NH2OH)为一元弱碱(25℃时,平衡常数Kb=9.0×10-9),其电离方程式为:NH2OH+H2ONH3OH++OH-。在25℃时,用0.10mol·L-1盐酸滴定20mL0.10mol·L-1NH2OH溶液,滴定过程中由水电离出来的H+浓度的负对数[-1gc水(H+)]与盐酸体积(V)的关系如图所示。(已知:lg3=0.5),下列说法中错误的是

A. a点对应溶液的pH=9.5
B. b点对应的溶液中有:c(NH3OH+)=c(Cl-)
C. c点溶液中存在离子反应:![]()
D. d点溶液中:-lgc水(H+)=13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学王晓琳教授首创三室膜电解法制备LiOH,其工作原理如图所示,下列有关说法正确的是

A. X电极连接电源负极
B. N为阳离子交换膜
C. Y电极反应式为 O2+2H2O+4e-=4OH-
D. 制备2.4g LiOH产生的H2在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.2kJ/mol
2NH3(g) ΔH=-92.2kJ/mol
(1)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为_____________。
②按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
(2)L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

ⅰ X代表的物理量是______。
ⅱ 判断L1、L2的大小关系,并简述理由:______。
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
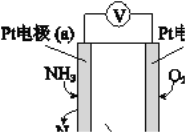
① 电极b上发生的是______反应(填“氧化”或“还原”)
② 写出电极a的电极反应式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料的碳一化学处于未来化学产业的核心,成为科学家研究的重要课题。
(1))已知CO、H2、CH3OH(g)的燃烧热分别为-283.0 kJ·mol-1、-285.8 kJ·mol-1、-764.5 kJ·mol-1。则反应Ⅰ:CO(g)+2H2(g)![]() CH3OH(g) ΔH=_____;。
CH3OH(g) ΔH=_____;。
(2)在T1时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如图所示。
CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如图所示。
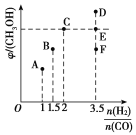
①当起始n(H2)/n(CO)=2时,经过5 min达到平衡,CO的转化率为0.6,则0~5 min内平均反应速率v(H2)=______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4 mol,达到新平衡时H2的转化率将____(填“增大”“减小”或“不变”)。
②当n(H2)/n(CO)=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
(3)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
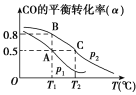
①A、B、C三点的平衡常数KA、KB、KC的大小关系为________。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为_____L。
(4)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的负极为__(填“A”或“B”),写出阳极的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌主要用作催化剂、脱硫剂、发光剂和橡胶添加剂。一种以锌焙砂(ZnO、ZnSiO3和少量As2O3、CuO、PbO杂质,其中As与N同主族)为原料制备氧化锌的流程如图所示:

请回答下列问题。
(1)循环使用的物质有____、____和______(填化学式)。
(2)“浸出”时,锌以Zn( NH3)42+进入滤液。

①浸出率与温度关系如图l所示,请解释温度超过55℃后浸出率显著下降的原因:___________
②浸出率与n(NH3):n[(NH4)2SO4]关系如图所示,6:4之后浸出率下降,说明____(填编号)的浸出主要依赖硫酸铵浓度的大小。
A.ZnO和ZnSiO3 B.ZnO C.ZnSiO3
(3)“除砷”过程中生成Fe3( AsO4)2沉淀,其中铁元素的化合价是____;沉淀剂为FeSO4·H2O、(NH3)2S2O8,添加(NH4)2S2O8的目的是____。
(4)“除重金属”和“深度除重金属”除去的重金属是____(填名称)。
(5)“蒸氨”的产物主要是ZnSO4和NH3,写出所发生反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.00g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示:
请回答下列问题:

(1)试确定110℃时固体物质的化学式___________ ;
(2)取200℃所得样品,加热至280℃,该反应的化学方程式为:__________________________________
(3)将280℃所得产物在570℃下灼烧得到的主要产物是1.60g黑色粉末和一种氧化性气体,黑色粉末的化学式为______________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com