
【题目】常温时,向20 mL 0.1![]() 的 CH3CH2COOH 溶液中滴加0.1
的 CH3CH2COOH 溶液中滴加0.1![]() 的NaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是
的NaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是

A. a 点溶液中 c(CH3CH2COO-) <c(Na+)
B. 图中四点,水的电离程度:c>d>b>a
C. c 点溶液中![]()
D. d 点溶液中c(Na+) +c(OH-) =c(H+) +c(CH3CH2COO-) +c(CH3CH2COOH)
【答案】C
【解析】
从酸碱滴定曲线入手,分析加入不同体积NaOH溶液时溶质的成分,据溶液酸碱性判断弱电解质电离和盐类水解的主次,以及酸碱盐对水的电离平衡的影响等。
A项:a 点加入10mLNaOH溶液,充分反应后所得溶液中含溶质CH3CH2COOH、CH3CH2COONa各0.001mol。因pH<7,则溶液中CH3CH2COOH电离程度大于CH3CH2COO-水解程度,c(CH3CH2COO-) >c(Na+),A项错误;
B项:NaOH溶液加入前,CH3CH2COOH微弱电离出的H+抑制水电离;随着NaOH溶液的加入,CH3CH2COOH溶液浓度减小,这种抑制作用减弱,水的电离程度增大;恰好中和时,生成的CH3CH2COO-水解,使水的电离程度达到最大;之后加入的NaOH溶液过量,NaOH完全电离生成的OH-抑制水电离,水的电离程度又逐渐减小。故水的电离程度:c>b>a>d,B项错误;
C项:据图,加入NaOH溶液前,0.1![]() CH3CH2COOH溶液pH=3,则溶液中c(CH3CH2COO-)≈c(H+)=10-3
CH3CH2COOH溶液pH=3,则溶液中c(CH3CH2COO-)≈c(H+)=10-3![]() ,c(CH3CH2COOH)=0.1
,c(CH3CH2COOH)=0.1![]() -10-3
-10-3![]() ≈0.1
≈0.1![]() ,常温时CH3CH2COOH电离常数Ka=10-5,CH3CH2COO-水解常数Kh=Kw/Ka=10-9。c点加入20mLNaOH溶液,两者恰好完全反应得CH3CH2COONa溶液(pH=9),溶液中有水解平衡CH3CH2COO-+H2O
,常温时CH3CH2COOH电离常数Ka=10-5,CH3CH2COO-水解常数Kh=Kw/Ka=10-9。c点加入20mLNaOH溶液,两者恰好完全反应得CH3CH2COONa溶液(pH=9),溶液中有水解平衡CH3CH2COO-+H2O![]() CH3CH2COOH+OH-,将Kh=10-9、c(OH-)=10-5
CH3CH2COOH+OH-,将Kh=10-9、c(OH-)=10-5![]() 代入Kh表达式,得
代入Kh表达式,得![]() ,C项正确;
,C项正确;
D项:d 点加入30mLNaOH溶液,充分反应后所得溶液中含溶质为0.002molCH3CH2COONa、0.001molNaOH。电荷守恒c(Na+) +c(H+) = c(OH-)+c(CH3CH2COO-),物料守恒2c(Na+) =3c(CH3CH2COO-)+3c(CH3CH2COOH),两式相减得c(Na+) -c(H+) = 2c(CH3CH2COO-)+3c(CH3CH2COOH)-c(OH-),进而有c(Na+) +c(OH-) =c(H+) +2c(CH3CH2COO-) +3c(CH3CH2COOH)>c(H+) +c(CH3CH2COO-) +c(CH3CH2COOH),D项错误。
本题选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.在![]() 、
、![]() N、
N、![]() O、
O、![]() Cl、
Cl、![]() U、
U、![]() U中:
U中:
(1)___和_____的质量数相等,但不能互称为同位素。
(2)___和____的中子数相等,但质子数不相等,所以不是同一种元素。以上所列共有______种元素。
Ⅱ.物质的类别和核心元素的化合价是研究物质性质的两个基本视角。

(3)Y的分子式为________。
(4)图中X的电子式为![]() ;其水溶液长期在空气中放置容易变浑浊,原因是________(用化学方程式表示);该变化体现出:S非金属性比O____(填“强”或“弱”)。用原子结构解释原因:同主族元素从上到下,__________,得电子能力逐渐减弱。
;其水溶液长期在空气中放置容易变浑浊,原因是________(用化学方程式表示);该变化体现出:S非金属性比O____(填“强”或“弱”)。用原子结构解释原因:同主族元素从上到下,__________,得电子能力逐渐减弱。
(5)Z与图表中某物质反应生成SO2的化学方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷在氧气中燃烧的反应为:P4 + 5O2 = P4O10。已知下列化学键的键能分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和有关数据,下列推断正确的是

A.6a+5d < 4c + 10b
B.△H = (4c+12b-6a-5d) kJ·mol-1
C.6a+5d > 4c + 12b
D.△H = (6a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molN2气体和3molH2气体在2L的恒容容器中,并在一定条件下发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g),若经2s后测得NH3的浓度为0.6mol·L-1,现有下列几种说法:其中不正确的是
2NH3(g),若经2s后测得NH3的浓度为0.6mol·L-1,现有下列几种说法:其中不正确的是
A. 用N2表示的反应速率为0.15mol·L-1·s-1 B. 2s时H2的转化率为40%
C. 2s时N2与H2的转化率相等 D. 2s时H2的浓度为0.6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.1 mo1·L-1的NH4HCO3溶液中逐滴加入NaOH,溶液中部分含氮、含碳微粒的分布情况如下图所示。下列说法不正确的是
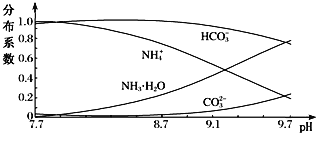
A. 开始阶段,HCO3- 增加的原因可能是:HCO3-的水解平衡逆向移动
B. pH在8.7~9.7之间,HCO3-和NH4+同时与OH-反应
C. 通过分析可知常温下:Kb(NH3·H2O)<Ka1(H2CO3)
D. pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下进行甲、乙、丙三组实验:各取30mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量(g) | 0.255 | 0.385 | 0.459 |
生成气体体积(mL) | 280 | 336 | 336 |
试回答:
(1)计算出盐酸的物质的量浓度为_______________mol/L(保留两位有效数字);
(2)镁、铝的物质的量之比为__________________;
(3)第三组还需要_____________mL的盐酸才能反应完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃在标准状况下的密度为3.215 g/L,现取3.6 g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4 g,碱石灰增重11 g,求:
(1)该烃分子的摩尔质量。
(2)确定该烃的分子式。
(3)已知该烃的一氯代物只有一种,写出该烃的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种关节炎止痛药,合成F的一种传统法的路线如下:
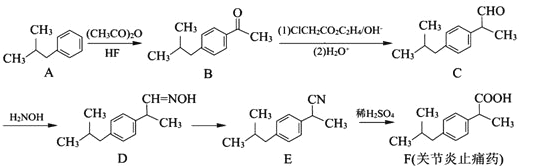
(1)B中含氧官能团的名称为_________。
(2)C→D的反应可分为两步,其反应类型为_________、_________。
(3)写出比F少5个碳原子的同系物X的结构简式:_______________(写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有_______________种。
①属于芳香族化合物;②苯环上只有1个取代基;③属于酯类物质;
(4)写出E转化为F和无机盐的化学方程式:______________________。
(5)已知:①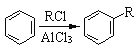
② 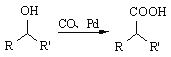 (R1、R2表示烃基)
(R1、R2表示烃基)
合成F的一种改良法是以2—甲基—1—丙醇[(CH3)2CHCH2OH)]、苯、乙酸酐[(CH3CO)2O]为原料来合成,写出有关的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH__________________
CH3CH2OH__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验:
①称取n g草酸晶体配成100.00 mL水溶液;
②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为a mol·L-1的KMnO4溶液滴定,已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答下列问题:
(1)实验中不考虑铁架台等夹持仪器外,需要的仪器有(填序号)___________,还缺少的仪器有(填名称)____________。
A.托盘天平(带砝码,镊子) B.滴定管 C. 100mL容量瓶 D.烧杯E.漏斗 F.锥形瓶 G.玻璃棒 H.烧瓶
(2)实验中KMnO4溶液应装在____式滴定管中,滴定终点的判断依据是_________________
(3)若在滴定前没有用amol·L-1的KMnO4溶液对滴定管进行润洗,则所测得的x值会___________(偏大、偏小、无影响)。
(4)若滴定终点读数时目光仰视,则计算出的x值可能_______________(填偏大、偏小、无影响)。
(5)滴定过程中用去V mL a mol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为_______mol·L-1 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com