
【题目】常温下,向0.1 mo1·L-1的NH4HCO3溶液中逐滴加入NaOH,溶液中部分含氮、含碳微粒的分布情况如下图所示。下列说法不正确的是
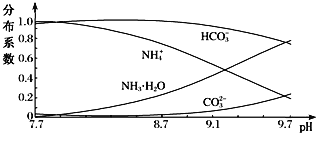
A. 开始阶段,HCO3- 增加的原因可能是:HCO3-的水解平衡逆向移动
B. pH在8.7~9.7之间,HCO3-和NH4+同时与OH-反应
C. 通过分析可知常温下:Kb(NH3·H2O)<Ka1(H2CO3)
D. pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
【答案】C
【解析】
NH4HCO3溶液中存在NH4+的水解平衡,即NH4++H2ONH3H2O+H+①;
HCO3-的水解平衡,即HCO3-+H2OH2CO3+OH-②;
HCO3-的电离平衡,即HCO3-H++CO32-③;
在未加氢氧化钠时,溶液的pH=7.7,呈碱性,则上述3个平衡中第②个HCO3-的水解为主,滴加氢氧化钠的开始阶段,氢氧根浓度增大,平衡②向逆方向移动,HCO3-的量略有增加;对于平衡①,氢氧根与氢离子反应,平衡正向移动,NH3H2O的量增加,NH4+的量减小,当pH大于8.7以后,CO32-的量在增加,平衡③受到影响,据此分析。
NH4HCO3溶液中存在NH4+的水解平衡,即NH4++H2O NH3H2O +H+①;
HCO3-的水解平衡,即HCO3-+H2OH2CO3+OH-②;
HCO3-的电离平衡,即HCO3-H++CO32-③;
A. 开始阶段,滴加氢氧化钠的开始阶段,氢氧根浓度增大,平衡②向逆方向移动,HCO3-的量略有增加,A项正确;
B. 对于平衡①,氢氧根与氢离子反应,平衡正向移动,NH3H2O的量增加,NH4+被消耗,当pH在8.7~9.7之间,CO32的量在增加,平衡③受到影响,HCO3被消耗,即碳酸氢根离子和铵根离子都与氢氧根离子反应,B项正确;
C. 在未加氢氧化钠时,溶液的pH=7.7,呈碱性,则说明HCO3-的水解程度大于NH4+的水解程度,根据盐类水解“越弱越水解”的规律可知,NH3·H2O的电离程度大于H2CO3的电离程度,即Kb(NH3·H2O)> Ka1(H2CO3),C项错误;
D.从图中可直接看出pH=9时,溶液中的离子浓度大小关系为:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-),D项正确;
答案选C。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】下表是元素剧期表的一部分,请根据要求填空

(1) 元素②最外层有_____个电子,在化合物中的最低负化合价为________;
(2) 元素⑤形成的离子的结构汞意图为_________;
(3) 用电子式表示元素①和⑦组成的化合物的形成过程:_______________;
(4) 元素④、⑤的最高价氧化物的水化物之间发生反应的离子方程式______________ 。
(5) 下列选项中能证明元素⑦的非金属性强于元素⑥的是________(双选)。
A.H2S的酸性弱于HCl B.S2-的还原性强于C1-
C.H2SO3的酸性强于HClO D.H2S不如HC1稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①NaHSO4晶体,②液态O2 ,③冰醋酸(固态醋酸), ④汞,⑤BaSO4固体,⑥Fe(OH)3 胶体,⑦酒精(C2H5OH) ,⑧熔化KNO3,⑨盐酸,⑩金属钠,请回答下列问题(用序号):
(1)以上物质中能导电的是__________
(2)以上物质属于电解质的是_____________
(3)以上物质中属于非电解质的是_______
(4)请写出①在熔融状态下的电离方程式________________
(5)a. 写出制备⑥的实验操作为_________;
b. 制备⑥的离子方程式为____________________,
c. 在制得的⑥中逐滴加入稀硫酸的实验现象为_____________________________。
(6)写出⑩在加热条件下与氧气反应的化学方程式________________________。若将2.3克钠放入97.7克水中,生成的溶液中溶质的质量分数_________(填“大于”、“小于” 或“等于”)2.3%。
(7)标准状况下,CO与CO2相对于②的密度为1,则混合气体中CO与CO2的比例为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名化学家徐光宪在稀土领域贡献突出,被誉为“稀土界的袁隆平”。钇是稀土元素之一,我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
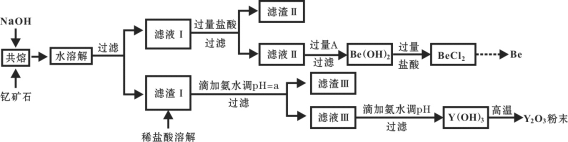
已知:ⅰ.钇(Y)的常见化合价为+3价;
ⅱ.铍和铝处于元素周期表的对角线位置,化学性质相似;
ⅲ.Fe3+、Y3+形成氢氧化物沉淀时的pH如下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.3 |
(1)将钇矿石与NaOH共熔的反应方程式补充完整:
__Y2FeBe2Si2O10+__NaOH+____ ![]() __Y(OH)3 +__Fe2O3 + __Na2SiO3 + __Na2BeO2 + __H2O
__Y(OH)3 +__Fe2O3 + __Na2SiO3 + __Na2BeO2 + __H2O
(2)滤渣Ⅱ的主要成分是____________。
(3)试剂A可以是___________。
A.NaOH溶液 B.氨水 C.CO2 D.CaO
(4)用氨水调节pH=a时,a的取值范围是_____________________。
(5)计算常温下Y3+ +3H2O![]() Y(OH)3+3H+的平衡常数K=________。(常温下Ksp [Y(OH)3] = 8.0×10-23)
Y(OH)3+3H+的平衡常数K=________。(常温下Ksp [Y(OH)3] = 8.0×10-23)
(6)滤液Ⅲ加入氨水产生沉淀的离子方程式为_______________。
(7)从BeCl2溶液中得到BeCl2固体的操作是________。
(8)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并请说明理由_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物可实现苯酚(![]() )废水的净化,装置如图所示。下列有关说法正确的是
)废水的净化,装置如图所示。下列有关说法正确的是
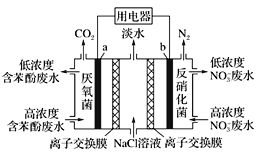
A. a极的电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
B. b极为正极,发生氧化反应
C. 中间室的Na+向左室移动
D. 右室生成0.1 mol N2时,用电器流过0.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20 mL 0.1![]() 的 CH3CH2COOH 溶液中滴加0.1
的 CH3CH2COOH 溶液中滴加0.1![]() 的NaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是
的NaOH溶液,溶液的pH与滴加NaOH溶液体积V的关系如图所示。下列说法正确的是

A. a 点溶液中 c(CH3CH2COO-) <c(Na+)
B. 图中四点,水的电离程度:c>d>b>a
C. c 点溶液中![]()
D. d 点溶液中c(Na+) +c(OH-) =c(H+) +c(CH3CH2COO-) +c(CH3CH2COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:2X(g)+Y(g) ![]() 2Z(g) △H<0,下图是表示该反应速率(v)随时间(t)变化的关系图。t1、t2、t5时刻外界条件均有改变(但都没有改变各物质的用量)。则下列说法中正确的是
2Z(g) △H<0,下图是表示该反应速率(v)随时间(t)变化的关系图。t1、t2、t5时刻外界条件均有改变(但都没有改变各物质的用量)。则下列说法中正确的是
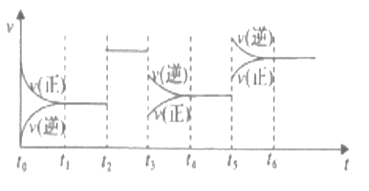
A. t6时刻后反应物的转化率最低 B. t5时增大了压强
C. t4时该反应的平衡常数小于t6时反应的平衡常数 D. t3时降低了温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图,下列说法正确的是( )

A. 若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B. 若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C. 若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D. 若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线②代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.5 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度:B<A<C
D. D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com