
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线②代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.5 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度:B<A<C
D. D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
【答案】D
【解析】
溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,加入NaOH后,溶液中离子浓度增大,溶液导电性增强;HCl是强电解质,随着NaOH溶液加入,溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当完全反应时离子浓度最小,继续加入NaOH溶液,离子浓度增大,溶液导电能力增强,根据图知,曲线②代表0.1 mol/L NaOH溶液滴定HC1溶液的滴定曲线,曲线①代表0.1 mol/LNaOH溶液滴定CH3COOH溶液的滴定曲线,据此分析。
根据上述分析可知,
A. 曲线①代表滴定CH3COOH溶液的曲线,故A项错误;
B. A点溶液中c(Na+) = 0.05 mol/L,电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO) + c(OH)c(H+) = c(Na+) = 0.05 mol/L,故B项错误;
C. 酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl。A点溶质为醋酸钠,可促进水电离,B点为等物质的量浓度的醋酸钠和NaOH,NaOH会抑制水的电离,则在相同温度下,由水的电离程度:B<C<A,故C项错误;
D. D点溶液中,c(Na+)=1.5 c(Cl),溶液中电荷守恒为c(Cl)+c(OH) = c(Na+)+c(H+),则c(Cl)=2c(OH)2c(H+),故D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】常温下,向0.1 mo1·L-1的NH4HCO3溶液中逐滴加入NaOH,溶液中部分含氮、含碳微粒的分布情况如下图所示。下列说法不正确的是
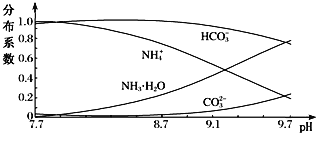
A. 开始阶段,HCO3- 增加的原因可能是:HCO3-的水解平衡逆向移动
B. pH在8.7~9.7之间,HCO3-和NH4+同时与OH-反应
C. 通过分析可知常温下:Kb(NH3·H2O)<Ka1(H2CO3)
D. pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 新制的氯水在光照条件下颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氢氧化铝的两性,最适宜的试剂是( )
A.AlCl3、氨水、稀盐酸B.![]() 、氨水、稀盐酸
、氨水、稀盐酸
C.Al、NaOH溶液、稀盐酸D.![]() 溶液、NaOH溶液、稀盐酸
溶液、NaOH溶液、稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验:
①称取n g草酸晶体配成100.00 mL水溶液;
②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为a mol·L-1的KMnO4溶液滴定,已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答下列问题:
(1)实验中不考虑铁架台等夹持仪器外,需要的仪器有(填序号)___________,还缺少的仪器有(填名称)____________。
A.托盘天平(带砝码,镊子) B.滴定管 C. 100mL容量瓶 D.烧杯E.漏斗 F.锥形瓶 G.玻璃棒 H.烧瓶
(2)实验中KMnO4溶液应装在____式滴定管中,滴定终点的判断依据是_________________
(3)若在滴定前没有用amol·L-1的KMnO4溶液对滴定管进行润洗,则所测得的x值会___________(偏大、偏小、无影响)。
(4)若滴定终点读数时目光仰视,则计算出的x值可能_______________(填偏大、偏小、无影响)。
(5)滴定过程中用去V mL a mol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为_______mol·L-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积不变的密闭容器中进行如下反应:N2(g)+3H2(g)![]() 2NH3(g),达到平衡。下列说法不正确的是( )
2NH3(g),达到平衡。下列说法不正确的是( )
A. 其它条件不变,缩小容器体积,平衡正向移动,K值变大
B. 其它条件不变,通入少量氦气,平衡不移动
C. N2、H2、NH3百分含量不再变化
D. 其它条件不变,升高温度,化学平衡一定发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.臭氧的摩尔质量是48 g
B.同温同压条件下,等质量的氧气和臭氧体积比为2∶3
C.16 g臭氧中含有6.02×1023个原子
D.1.00 mol臭氧中含有电子总数为18×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+ N2H4·H2O +NaCl
实验一:制备NaClO溶液。(实验装置如右图所示)
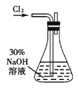
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应的离子方程式是 。
(3)设计实验方案:用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度(实验提供的试剂:H2O2溶液、FeCl2溶液、0.10 mol·L-1盐酸、酚酞试液): 。
实验二:制取水合肼。(实验装置如右图所示)
(4)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。分液漏斗中的溶液是 (填标号)。A.CO (NH2)2溶液 B.NaOH和NaClO混合溶液原因是: (用化学方程式表示)。
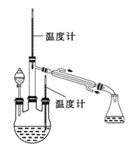
实验三:测定馏分中肼含量。
(5)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O + 2I2= N2↑+ 4HI + H2O)
①滴定时,碘的标准溶液盛放在 (填“酸式”或“碱式”)滴定管中;本实验滴定终点的现象为 。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com