
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+ N2H4·H2O +NaCl
实验一:制备NaClO溶液。(实验装置如右图所示)
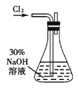
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应的离子方程式是 。
(3)设计实验方案:用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度(实验提供的试剂:H2O2溶液、FeCl2溶液、0.10 mol·L-1盐酸、酚酞试液): 。
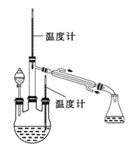
实验二:制取水合肼。(实验装置如右图所示)
(4)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。分液漏斗中的溶液是 (填标号)。A.CO (NH2)2溶液 B.NaOH和NaClO混合溶液原因是: (用化学方程式表示)。
实验三:测定馏分中肼含量。
(5)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O + 2I2= N2↑+ 4HI + H2O)
①滴定时,碘的标准溶液盛放在 (填“酸式”或“碱式”)滴定管中;本实验滴定终点的现象为 。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
【答案】(1)B、D(2)Cl2+ 2OH-= ClO-+ Cl-+ H2O(3)取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用 0.10mol·L-1盐酸滴定,记录消耗盐酸的量,重复上述操作2~3次。(其它合理答案给分)(4) B N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl(5)酸式 溶液出现蓝色且半分钟内不消失(6)9%
【解析】
试题(3) 取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用 0.10mol·L-1盐酸滴定,记录消耗盐酸的量,重复上述操作2~3次,加入H2O2防止次氯酸根的在酸性条件下分解产生盐酸和氧气,干扰实验结果的测定。(4) B.NaOH和NaClO混合溶液,次氯酸根离子在酸性和加热条件下容易分解,所以分液漏斗中的液体是NaOH和NaClO混合溶液。(5) ①碱式滴定管上的橡皮管易被碘水腐蚀,故用酸式滴定管;②由化学方程式的三段式可知n(N2H4·H2O)=1/2n(I2)=1.8mol,故W(N2H4·H2O)=((1.8×10-3×50)/5)×100%=9%。


科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线②代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.5 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度:B<A<C
D. D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及____________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为________,阴离子的中心原子轨道采用________杂化。
(2)已知苯酚(![]() )具有弱酸性,其Ka=1.1×10-10,水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10,水杨酸第一级电离形成的离子![]() 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 醋酸溶解水垢中的CaCO3: CaCO3 + 2H+= Ca2++ H2O + CO2↑
B. 惰性电极电解饱和MgCl2溶液: Mg2++2Cl- + 2H2O ![]() Mg(OH)2↓ + H2↑ + Cl2↑
Mg(OH)2↓ + H2↑ + Cl2↑
C. 苯酚钠溶液中通入少量的CO2:![]() +H2O+CO2→
+H2O+CO2→ +
+![]()
D. 用银氨溶液检验乙醛中的醛基:CH3CHO+![]() +2OH-
+2OH-![]() CH3COONH4+H2O+2Ag↓+3NH3↑
CH3COONH4+H2O+2Ag↓+3NH3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了缓解温室效应,科学家提出了多种回收和利用CO2的方案。
方案I:利用FeO吸收CO2获得H2
i.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △Hl=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)==CO2(g)+2H2(g) △H2=+113.4kJ/mol (1)3FeO(s)+H2O(g)=Fe3O4(s)+H2(g) △H3=__________。
(2)在反应i中,每放出38.0kJ热量,有______gFeO被氧化。
方案II:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2mol CO2和8molH2,发生反应CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+2H2O(g) △H4,混合气体中CH4的浓度与反应时间的关系如图所示。

(3) ①从反应开始到恰好达到平衡时,H2的平均反应速率v(H2)=________。
②300℃时,反应的平衡常数K=________。
③保持温度不变,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度_______(填字母)。
A.等于0.8mol/L B.等于1.6mol/L
C.0.8 mol/L <c(CH4)<1.6 mol/L D.大于1.6 mol/L
(4)300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g),则v正____v逆(填“>”“<”或“=”)。
(5)已知:200℃时.该反应的平衡常数K=61.8L2·mol-2。则△H4___0(填“>”“<”或“=”)。
方案Ⅲ:用碱溶液吸收CO2
利用100mL3mol/LNaOH溶液吸收4.48LCO2(标准状况),得到吸收液。
(6)该吸收液中离子浓度的大小排序为____________。将该吸收液蒸干,灼烧至恒重,所得固体的成分是_______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是

A. 电极Y为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2+3H22NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成![]() 键、
键、![]() 键、1molN≡N放出能量分别为436kJ、391kJ、946kJ。则:
键、1molN≡N放出能量分别为436kJ、391kJ、946kJ。则:
(1)若完全反应生成2mol![]() 可______
可______![]() 填“吸收”或“放出”
填“吸收”或“放出”![]() 热量______kJ。
热量______kJ。
(2)如果将![]() 和
和![]() 混合,使其充分反应,放出的热最总小于上述数值,其原因是______。
混合,使其充分反应,放出的热最总小于上述数值,其原因是______。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10min后,生成![]() ,则用
,则用![]() 表示的化学反应速率为______。
表示的化学反应速率为______。
(4)在四个不同容器中,不同条件下进行合成氨反应。根据在相同时内内测定的结果,判断该反应的速率由大到小的顺序是______![]() 用编号填写
用编号填写![]() 。
。
A.v(NH3)=0.5mol/(Lmin) B. v(H2)=0.3mol/(Lmin)
C.v(N2)=0.2mol/(Lmin) D. v(H2)=0.01mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定有机物A的结构,某研究团队对有机物A进行了多项实验,得实验结果如下:
①有机物A经李比希法分析知:含碳77.8%,氢为7.40%,其余为氧;
②质谱法分析A得知其相对分子质量为108;
③经红外光谱测定,A分子结构中含有苯环和羟基;
④A的核磁共振氢谱显示其有4种峰,且峰面积比为3∶2∶2∶1;
⑤A为无色晶体,常温下微溶于水;能与烧碱反应,且在常温下A可与浓溴水反应,1 mol A最多可消耗浓溴水中2 mol Br2。
求:(1)该有机物的分子式为________________。
(2)确定该有机物的结构简式:___________________,写出其与足量浓溴水反应的化学方程式:__________。
(3)含有苯环的A的同分异构体还有____________种(不含A),请写出其中属于醇的同分异构体与氧气加热(铜作催化剂)的反应方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com