
����Ŀ����֪��������ӵ�ص��ܷ�ӦʽΪ2Li+FeS=Fe+Li2S��LiPF6��SO(CH3)2Ϊ����ʣ��øõ��Ϊ��Դ��⺬�����Է�ˮ���õ�����Ni��ʵ��װ����ͼ��ʾ������˵������ȷ����

A. �缫YΪLi
B. �������У�b��NaCl��Һ�����ʵ���Ũ�Ƚ����ϼ�С
C. X����ӦʽΪFeS+2Li++2e-=Fe+Li2S
D. ����ͼ��������Ĥȥ������a��b���Һϲ������ⷴӦ�ܷ���ʽ�����ı�
���𰸡�B
��������A. �������������ŵ磬��˶�����������������缫Y��������ΪLi��A��ȷ��B. ̼�����������������ŵ磬������ͨ��������Ĥ����b�ң�c�е�������ͨ�������ӽ���Ĥ����b�ң����Ե������У�b��NaCl��Һ�����ʵ���Ũ�Ƚ���������B������C. X������������ӦʽΪFeS+2Li++2e-=Fe+Li2S��C��ȷ��D. ����ͼ��������Ĥȥ������a��b���Һϲ��������������ӷŵ�����˵�ⷴӦ�ܷ���ʽ�����ı���D��ȷ����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ģ�ҵƯ��Һ����Ч�ɷ�ΪNaClO���ѳ���ˮ�а�����NH3�����������£�

���з�����ȷ����
A. ���в�������ķ������ƴ���ˮ
B. ������������Ҫ�缫��Ӧ��4OH- - 4e- = 2H2O + O2��
C. �����Ʊ�Ư��Һ�ķ�Ӧ��Cl2 + OH- = Cl- + HClO
D. �ڡ��ۡ����о�������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������������;���ж�Ӧ��ϵ���ǣ� ��
A.Na2O2����CO2����O2��������������߹�����
B.Al2O3��������������������²���
C.SiO2Ӳ�ȴ�����������ά
D.NH3������ˮ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E�������ʾ�����ͬһ��Ԫ��X������֮��������ת����ϵ��
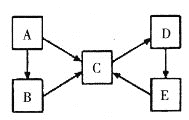
(1)��AΪ���ʣ���B��C�������࣬��A��B��C��Ԫ��X�Ļ��ϼ��������ߣ�C��D��E��Ԫ��X�Ļ��ϼ���ͬ����D����ɫΪ__________��E������Ϊ____________��
(2)��AΪ���ʣ�B��C���������࣬��B��C��ˮ��Һ�к�XԪ�ص��������������֮��Ϊ3��1��D��һ�ְ�ɫ��������Ԫ��X�����ڱ��е�λ����____________��A��C�ķ�Ӧ���������Ļ�ѧʽΪ___________��C��D��Ӧ�����ӷ���ʽΪ__________________________________��
(3)��A~E��Ϊ�����A�ǵ���ɫ���壬C��D��E���������࣬D��E��C���ҹ���ѧ�ҷ����ľ��乤ҵ�Ʊ�C�ķ�������A�ĵ���ʽΪ___________��D��E�Ļ�ѧ����ʽΪ��____________________________________��
(4)��AΪ���ʣ�C��D����Է����������16��B��E������Ӧֻ����һ�ֲ�����������ࡣ��B��C�Ļ�ѧ����ʽΪ____________________________��E��C_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������״���;����㷺��Խ��Խ�����̼ҵĹ�ע����ҵ�ϼ״��ĺϳ�;�����ֶ���������ʵ������ģ��״��ϳɷ�Ӧ����2L�ܱ������ڣ�400��ʱ��Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H<0����ϵ��n(CO)��ʱ��ı仯���±���
CH3OH(g) ��H<0����ϵ��n(CO)��ʱ��ı仯���±���
ʱ��(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)ͼ�б�ʾCH3OH�ı仯��������_______��

(2)��H2��ʾ��0~2s�ڸ÷�Ӧ��ƽ������v(H2)=___________________��
(3)�÷�Ӧ�ﵽ�����ʱCO��ת����Ϊ___________��
(��ʾ��ת����=![]() ��100%)
��100%)
(4)��˵���÷�Ӧ�Ѵﵽƽ��״̬����______��
a. CO��H2��Ũ�ȱ��ֲ��� b. �������ܶȱ��ֲ���
c. ������ѹǿ���ֲ��� d. ÿ����1molCH3OH��ͬʱ��2mol H�CH�γ�
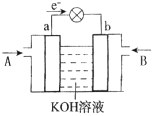
(5)CH3OH��O2�ķ�Ӧ�ɽ���ѧ��ת��Ϊ���ܣ��乤��ԭ������ͼ��ʾ��ͼ��CH3OH��______(��A��B)ͨ�롣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ֱ���ж������Ȼ�ѧ����ʽ��д����ȷ����( )
A. 1/2H2(g)+1/2Cl2(g)![]() HCl(g)��H=-91.5 kJ/mol
HCl(g)��H=-91.5 kJ/mol
B. 1/2H2(g)+1/2Cl2(g)![]() HCl(g)��H=+91.5 kJ/mol
HCl(g)��H=+91.5 kJ/mol
C. H2(g)+Cl2(g)![]() 2HCl(g) ��H=-183 kJ/mol
2HCl(g) ��H=-183 kJ/mol
D. 2HCl(g)![]() H2(g)+Cl2(g) ��H=+183kJ/mol
H2(g)+Cl2(g) ��H=+183kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£� 2�ӣ���������![]() 2�ӣ���������Ӧ���ȣ��Ѵ�ƽ�⣬���������������䣬ֻ�ı�����һ��������v(��)��v(��)�ı仯��ͼ��ʾ�������ж���ȷ���� �� ��
2�ӣ���������Ӧ���ȣ��Ѵ�ƽ�⣬���������������䣬ֻ�ı�����һ��������v(��)��v(��)�ı仯��ͼ��ʾ�������ж���ȷ���� �� ��
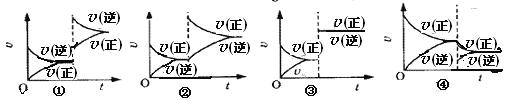
A. ��ͼ���������ڼ�ѹ��ʹ���������С�����
B. ��ͼ�����������¶������
C. ��ͼ�����Ǽ�ѹ����С������������
D. ��ͼ��ֻ������SO3��Ũ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������298K��100kPaʱ����1Lˮ�п��ܽ�0.09mol������ʵ��������ˮ��Cl2Լ������֮һ��ˮ��Ӧ����ش��������⣺
��1����ʽ���Ƽ���÷�Ӧ��298K��ƽ�ⳣ��___________��
��2���������������ѹǿ��ƽ�⽫��______________�ƶ���
�������ˮ�ⷴӦ����ʽΪ��HCOOCH3��1��+H2O��1��![]() HCOOH(l)+CH3OH��1�� ��H��0
HCOOH(l)+CH3OH��1�� ��H��0
ijС��ͨ�������о��÷�Ӧ����Ӧ����������仯���Բ��ƣ�����Ӧ��ϵ�и���ֵ���ʼ�����±���
��� | HCOOCH3 | H2O | HCOOH | CH3OH |
���ʵ���/mol | 1.00 | 1.99 | 0.01 | 0.52 |
�������ת�������¶�T1���淴Ӧʱ�䣨t���ı仯����ͼ��

��3�������15��20min��Χ�ڼ�������ļ�����Ϊ____________________mol
��4�������������������㲻ͬʱ�䷶Χ�ڼ��������ƽ����Ӧ���ʣ�������±���
��Ӧʱ�� / min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 60~65 |
ƽ����Ӧ���� /(10-3mol��min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
�����������ݣ����÷�Ӧ�ķ�Ӧ�����ڲ�ͬ�εı仯���ɣ�________����ԭ���ǣ�_________ ��
��5�������������䣬���ı��¶�ΪT2��T2����T1�����ڴ����ͼ�л����¶�T2�¼������ת�����淴Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼ��__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л���A�����б�����������ѧʽC8H8����CCl4Ϊԭ�Ϻϳɱ�������E���������£�
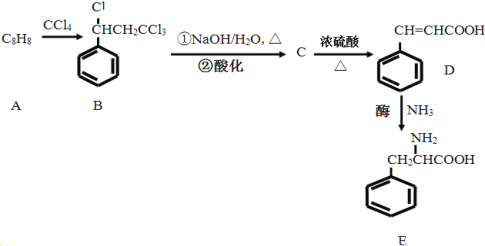
��֪���������е���ԭ�ӱ�±��ԭ��ȡ�������ɵ����������±��������CH3CH2Cl��±������NaOHˮ��Һ���������»�ˮ�⣬�磺
CH3CH2Cl+NaOH![]() CH3CH2OH+NaCl
CH3CH2OH+NaCl
CH2ClCH2Cl+2NaOH![]() CH2OHCH2OH+2NaCl
CH2OHCH2OH+2NaCl
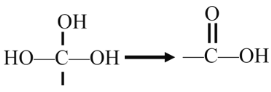 ���÷�Ӧ����Ҫ������Ѹ��ת����
���÷�Ӧ����Ҫ������Ѹ��ת����
R��CH2CH2OH![]() R��CH��CH2��H2O
R��CH��CH2��H2O
��1��D��E�ķ�Ӧ����Ϊ_____________________��
��2��A�Ľṹ��ʽΪ________________________��
��3���й�D�������������___________������ţ���
a����ʹ����KMnO4��Һ��ɫ b���������CCl4��Һ��Ӧ
c������״�����������Ӧ d���ܷ���ˮ�ⷴӦ
��4��C��D��Ӧ�Ļ�ѧ����ʽΪ___________________________________��
��5����������������E��ͬ���칹�干��_________�֡�
���������ࣻ�ڱ�����ֻ��������λȡ����������һ��Ϊ��NH2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com