
����Ŀ������298K��100kPaʱ����1Lˮ�п��ܽ�0.09mol������ʵ��������ˮ��Cl2Լ������֮һ��ˮ��Ӧ����ش��������⣺
��1����ʽ���Ƽ���÷�Ӧ��298K��ƽ�ⳣ��___________��
��2���������������ѹǿ��ƽ�⽫��______________�ƶ���
�������ˮ�ⷴӦ����ʽΪ��HCOOCH3��1��+H2O��1��![]() HCOOH(l)+CH3OH��1�� ��H��0
HCOOH(l)+CH3OH��1�� ��H��0
ijС��ͨ�������о��÷�Ӧ����Ӧ����������仯���Բ��ƣ�����Ӧ��ϵ�и���ֵ���ʼ�����±���
��� | HCOOCH3 | H2O | HCOOH | CH3OH |
���ʵ���/mol | 1.00 | 1.99 | 0.01 | 0.52 |
�������ת�������¶�T1���淴Ӧʱ�䣨t���ı仯����ͼ��

��3�������15��20min��Χ�ڼ�������ļ�����Ϊ____________________mol
��4�������������������㲻ͬʱ�䷶Χ�ڼ��������ƽ����Ӧ���ʣ�������±���
��Ӧʱ�� / min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 60~65 |
ƽ����Ӧ���� /(10-3mol��min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
�����������ݣ����÷�Ӧ�ķ�Ӧ�����ڲ�ͬ�εı仯���ɣ�________����ԭ���ǣ�_________ ��
��5�������������䣬���ı��¶�ΪT2��T2����T1�����ڴ����ͼ�л����¶�T2�¼������ת�����淴Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼ��__________
���𰸡�0.00045 ����Ӧ���� 0.045 ��������С�� ���ŷ�Ӧ���У�����HCOOH�������࣬ʹ��Һ������ǿ����ˮ��ٽ���������Ӧ��������Ӧ��һ��ʱ�䣬HCOOCH3��Ũ�ȼ�С��ˮ�����ʼ����� 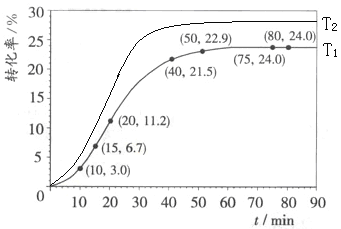
��������
��1Lˮ�п��ܽ�0.09mol����,��������Ũ��Ϊ0.09mol/L ;���ƽ�����ƽ��״̬����Ũ��,����ƽ�ⳣ���������õ�; ������ƽ����Ӧ���ʵ�������ʾ��Ӧ������������С����÷�Ӧ�����ȷ�Ӧ���ų��¶����ߵ�Ӱ�죬��ֻ���Ƿ�Ӧ��ϵ�е�ij���ʶԸ÷�Ӧ�����á�
(1)��1Lˮ�п��ܽ�0.09mol ����,��������Ũ��Ϊ0.09mol/L;����ƽ������ʽ��ʽ����õ�ƽ��Ũ��:
Cl2 + H2O H+ + Cl- + HClO
��ʼŨ��:0.09 0 0 0
ת��Ũ��:0.03 0.03 0.030.03
ƽ��Ũ��:0.06 0.030.030.03
K=![]() =(0.03
=(0.03![]() 0.03
0.03![]() 0.03)/0.06=0.00045
0.03)/0.06=0.00045
��ˣ�����: 0.00045 ;
��2��������ƽ�����������������ѹǿ,ƽ�������������С�ķ�Ӧ�������,ƽ�ⶼ������Ӧ�����ƶ�,��ˣ�����:����Ӧ����;
��3��HCOOCH3��1��+H2O��1��![]() HCOOH(l)+CH3OH��1�� ��H��0,15 min���������ת����Ϊ6.7
HCOOH(l)+CH3OH��1�� ��H��0,15 min���������ת����Ϊ6.7![]() ,20min���������ת����Ϊ11.2
,20min���������ת����Ϊ11.2![]() ��HCOOCH3�ij�ʼ��Ϊ1mol������15��20min��Χ�ڼ�������ļ�����Ϊ1mol
��HCOOCH3�ij�ʼ��Ϊ1mol������15��20min��Χ�ڼ�������ļ�����Ϊ1mol ![]() (11.2
(11.2![]() -6.7
-6.7![]() )=0.045mol,�𰸣�0.045
)=0.045mol,�𰸣�0.045
��4��������ƽ����Ӧ���ʵ�������ʾ��Ӧ������������С����÷�Ӧ�����ȷ�Ӧ���ų��¶����ߵ�Ӱ�죬��ֻ���Ƿ�Ӧ��ϵ�е�ij���ʶԸ÷�Ӧ�����á��÷�Ӧ�м�����д����á�����Ӧ���ڣ���Ȼ����������ϴ���������С����Ч�������ԣ���Ӧ���ʽ���������Ӧ���ڣ������������࣬��Ч����������Ӧ����������������Ӧ���ڣ����������ӵ�һ���̶Ⱥ�Ũ�ȶԷ�Ӧ���ʵ�Ӱ���Ϊ�������أ��ر����淴Ӧ���ʵ�����ʹ�ܷ�Ӧ������С��ֱ��Ϊ��ﵽƽ��״̬���𰸣���������С�����ŷ�Ӧ���У�����HCOOH�������࣬ʹ��Һ������ǿ����ˮ��ٽ���������Ӧ��������Ӧ��һ��ʱ�䣬HCOOCH3��Ũ�ȼ�С��ˮ�����ʼ�����
��5����Ϊ�÷�Ӧ�����ȷ�Ӧ��T2>T1���¶����ߣ����ܼӿ췴Ӧ���ʣ��������̴ﵽƽ���ʱ�䣬���ת���ʡ������������䣬���ı��¶�ΪT2��T2����T1�������¶�T2�¼������ת�����淴Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼΪ��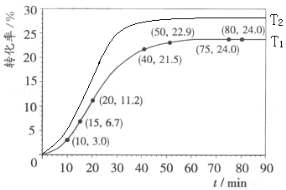 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܿ�����ָʾ���ʹ������Ʊ�����ˮ�ܿ���Ҫ�ɷ�ΪCo2O3��������Fe2O3��A12O3��MnO��MgO��CaO��SiO2�ȣ���ȡCoC2O4��2H2O�����������£�

��֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
�����������£�ClO3-��������Co2+��ClO3-ת��ΪCl-��
�۲���������������������ʽ����ʱ��Һ��pH������
������ | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
��ȫ������pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
��1�����������м���Na2SO3����ҪĿ����________��
��2�������Һ�м���NaClO3�����ӷ�Ӧ����ʽ��_________��
��3����֪��������NH3��H2O![]() NH4+��OH- Kb��1.8��10-5
NH4+��OH- Kb��1.8��10-5
H2C2O4![]() H+��HC2O4- Ka1��5.4��10-2
H+��HC2O4- Ka1��5.4��10-2
HC2O4-![]() H��C2O42- Ka2��5.4��10-5
H��C2O42- Ka2��5.4��10-5
�������������(NH4)2C2O4��Һ��pH______7�������������=������
��4������(NH4)2C2O4 ��Һ���������壬�ٹ��ˡ�ϴ�ӣ�ϴ��ʱ��ѡ�õ��Լ��У�________��
A������ˮ B������ˮ C�����͵�(NH4)2C2O4��Һ D��ϡ����
��5����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ����ͼ1����ȡ����������________����ʹ�õ�����pH��Χ��________��
A��2.0��2.5 B��3.0��3.5 C��4.0��4.5
��6��CoC2O4��2H2O�ȷֽ������仯������ͼ2��ʾ������600����ǰ�Ǹ����������ȣ�600 ���Ժ����ڿ����м��ȡ�A��B��C��Ϊ�����C����ʾ����Ļ�ѧʽ��________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������ӵ�ص��ܷ�ӦʽΪ2Li+FeS=Fe+Li2S��LiPF6��SO(CH3)2Ϊ����ʣ��øõ��Ϊ��Դ��⺬�����Է�ˮ���õ�����Ni��ʵ��װ����ͼ��ʾ������˵������ȷ����

A. �缫YΪLi
B. �������У�b��NaCl��Һ�����ʵ���Ũ�Ƚ����ϼ�С
C. X����ӦʽΪFeS+2Li++2e-=Fe+Li2S
D. ����ͼ��������Ĥȥ������a��b���Һϲ������ⷴӦ�ܷ���ʽ�����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A. Mg�Ľ����Ա�Alǿ B. H�������Ӱ뾶����Li��
C. HCl�����ȶ��Ա�HFǿ D. HClO4�����Ա�H3PO4ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ƽ����ϵ�У������¶�һ��ʱ���ı�ijһ���ʵ�Ũ�ȣ�����������ɫ��ı䣻�ı�ѹǿʱ����ɫҲ��ı䣬��ƽ�Ⲣ���ƶ��������Ӧ�ǣ� ��
A. 2NO��O2![]() 2NO2 B. Br2(g)��H2
2NO2 B. Br2(g)��H2 ![]() 2HBr
2HBr
C. N2O4 ![]() 2NO2 D. 6NO��4NH3
2NO2 D. 6NO��4NH3 ![]() 5N2��3H2O
5N2��3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ���ܴ����������������
A.H����OH����Na��B.K����NO3����Cu2+
C.Ba2+��SO42����Na+D.Fe3+��OH����NH4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�����ս����һ31ʹ���˸�ǿ�ȡ����µ��ѺϽ���ϡ���ҵ��ұ���ѵķ�ӦΪTiCl4+2Mg=Ti+2MgCl2�������йظ÷�Ӧ��˵����ȷ���ǣ� ��
A.Mg������B.TiCl4�ǻ�ԭ��
C.Ti����������D.24g Mg�μӷ�Ӧת��1mol e-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����()
A. Ħ����һ������������
B. 1mol H2O��������ԭ�ӵ�����Ϊ16g
C. 10L������8L��������H2�����ʵ�����
D. ij���ʺ���6.02��1023������,������ʵ����Ϊ22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������غ������������Һ�ܷ���������ԭ��Ӧ��![]() ��֪�÷�Ӧ��������
��֪�÷�Ӧ��������![]() ��������ӿ�
��������ӿ�![]() Ϊ
Ϊ![]() ������ʱ���ϵͼ������˵������ȷ����
������ʱ���ϵͼ������˵������ȷ����
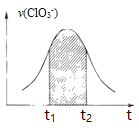
A. ��Ӧ��ʼʱ��������һ�����¶���������
B. ������Ϊ![]() ��
��![]() ������ͼ�����߲��غ�
������ͼ�����߲��غ�
C. ͼ����Ӱ���ֵ������ʾ![]() ʱ����
ʱ����![]() �ļ�С
�ļ�С
D. ���ڷ�Ӧ�����½�����Ҫԭ���Ƿ�Ӧ��Ũ�ȼ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com