
����Ŀ�������ܿ�����ָʾ���ʹ������Ʊ�����ˮ�ܿ���Ҫ�ɷ�ΪCo2O3��������Fe2O3��A12O3��MnO��MgO��CaO��SiO2�ȣ���ȡCoC2O4��2H2O�����������£�

��֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
�����������£�ClO3-��������Co2+��ClO3-ת��ΪCl-��
�۲���������������������ʽ����ʱ��Һ��pH������
������ | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
��ȫ������pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
��1�����������м���Na2SO3����ҪĿ����________��
��2�������Һ�м���NaClO3�����ӷ�Ӧ����ʽ��_________��
��3����֪��������NH3��H2O![]() NH4+��OH- Kb��1.8��10-5
NH4+��OH- Kb��1.8��10-5
H2C2O4![]() H+��HC2O4- Ka1��5.4��10-2
H+��HC2O4- Ka1��5.4��10-2
HC2O4-![]() H��C2O42- Ka2��5.4��10-5
H��C2O42- Ka2��5.4��10-5
�������������(NH4)2C2O4��Һ��pH______7�������������=������
��4������(NH4)2C2O4 ��Һ���������壬�ٹ��ˡ�ϴ�ӣ�ϴ��ʱ��ѡ�õ��Լ��У�________��
A������ˮ B������ˮ C�����͵�(NH4)2C2O4��Һ D��ϡ����
��5����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ����ͼ1����ȡ����������________����ʹ�õ�����pH��Χ��________��
A��2.0��2.5 B��3.0��3.5 C��4.0��4.5
��6��CoC2O4��2H2O�ȷֽ������仯������ͼ2��ʾ������600����ǰ�Ǹ����������ȣ�600 ���Ժ����ڿ����м��ȡ�A��B��C��Ϊ�����C����ʾ����Ļ�ѧʽ��________��

���𰸡� ��Co3+��Fe3+��ԭΪCo2+��Fe2+��ֻҪ�ش�Co3+��ԭΪCo2+�����֣����� ClO3-��6Fe2+ + 6H+= Cl-��6Fe3+ + 3H2O �� A ��ȥ��Һ�е�Mn2+ B Co2O3
��������(1)�������ƾ��л�ԭ�ԣ��ܻ�ԭ����������Fe3+��Co3+�����Խ��������м���Na2SO3��Ŀ���ǽ�Fe3+��Co3+��ԭ����ԭΪFe2+��Co2+��
(2)NaClO3���������ԣ��ܽ�����Һ�е�Fe2+������Fe3+����������ԭ���������ӣ�ͬʱ����ˮ�����ӷ�Ӧ����ʽΪClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O��
(3)����ˮ�⣬˭ǿ��˭�ԣ�NH3H2ONH4++OH- Kb=1.8��10-5��HCO4-H++C2O42- Ka2=5.4��10-5������(NH4)2C2O4��Һ��笠�����ˮ����ڲ��������ˮ�⣬��Һ�����ԣ���PH��7��
(4)Ϊ��ȥ(NH4)2C2O4 �������ĸ���Һ��ϴ��ʱ��ѡ������ˮϴ�ӣ������ɵõ��������ľ��壬�ʴ�ΪA��
(5)��������ͼ��֪����ʱ��Һ�д���Mn2+��Co2+�������ӣ�����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��֪��������ҺPH��3.0��3.5֮�䣬��ΪB����ʹMn2+��ȫ����������ֹCo2+ת��ΪCo(OH)2������
(6)��ͼ��֪��C��������������Ϊ8.03g��0.1molCoԪ������Ϊ5.9g������������Ԫ������Ϊ8.03g-5.9g=2.13g������������Coԭ����Oԭ�����ʵ���֮��Ϊ0.1mol�� ![]() ��2:3����C��Co������ΪCo2O3��
��2:3����C��Co������ΪCo2O3��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ý���������ֱ�ӷ�Ӧ�Ƶõ��Ȼ�����ǣ�������
A.FeCl2
B.MgCl2
C.CuCl2
D.NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ����ʵĵ�������ͨ��������½��е�
B. ǿ�������Һ�ĵ���������һ�������������Һǿ
C. ������ǿ����ʣ�����������û��HCl����
D. H2O(g)==H2O(l)�Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L�ܱ������У�800��ʱ��Ӧ2NO��g����O2��g��![]() 2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��������Ӧ________����ǡ����ǡ������淴Ӧ��
��2����ͼ��ʾ����ʾNO2�仯���ߵ���______����O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v��________��

��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����________�����������
a��v��NO2����2v��O2��
b��������ѹǿ���ֲ���
c��v����NO����2v����O2��
d���������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƿ��������Ʊ�����ƽ���������李��Դ���Ϊԭ���Ʊ��������ƾ��壨NaClO4��H2O�����������£�

��1�������ơ��У��ɴ���(��Ca2����Mg2����SO42��������)�Ʊ�������ˮʱ���õ�NaOH��BaCl2��Na2CO3���Լ�������Na2CO3��Һ������
��2������⡱��2�����У��䷴Ӧ�ֱ�ΪNaCl��3H2O![]() NaClO3��3H2�� NaClO3��H2O
NaClO3��3H2�� NaClO3��H2O![]() NaClO4��H2��
NaClO4��H2��
��3�������ӡ���Ŀ���dz�ȥ����δ������NaClO3,�÷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��4�������롱�IJ����ֱ��Ǽ���Ũ���� ����ȴ�ᾧ�����ˡ�ϴ�ӡ�����������ʵ��ܽ������ͼ��ʾ��
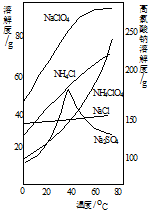
��5�������½��õ��ĸ������ƾ�������Ȼ�隣�����Һ�У���Ӧ�����ӷ���ʽΪ��
��6��Ϊȷ�����ø������ƾ���Ĵ��ȣ���������Na2SO4���ʣ�����������ʵ�飺
��ȷ��ȡ3.00 g��Ʒ��ˮ����ܽ⣬������Һת��������ƿ�����ó�100 mL��Һ��
����ȡ25.00 mL��Һ������������KI��Һ��ַ�Ӧ(ClO4������ԭ��Cl��)���ٵμ�1.000 mol��L��1 Na2S2O3��Һ���з�Ӧ����ӦΪI2��2 Na2S2O3=2 NaI�� Na2S4O6����ǡ������40.00 mL Na2S2O3��Һ��
�����������ݼ�����Ʒ�и������ƾ��崿��Ϊ�� ��д��������̣�������λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A. HCHO�����мȺ������ֺ�����
B. CO2�����еĻ�ѧ��Ϊ�Ǽ��Լ�
C. NH3������Nԭ�ӵ��ӻ����������sp2
D. �е㣺PH3>NH3>H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A������һ��ǿ��ԭ�������Խ��ѡ�������������Ȼ�����Һ���û�����
B��ͭ�����Ȼ�����Һ��Ӧ���÷�Ӧ����Ӧ����ӡˢ��·�������
C�����Ƿ�����118��Ԫ�أ�������118�ֺ���
D��H2��D2��Ϊͬλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������������( )
A������ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ֧�ܿ�
B����Һʱ����Һ©�����²�Һ����¿ڷų����ϲ�Һ����Ͽڵ���
C���þƾ���ȡ��ˮ�еĵ�
D������ŨH2SO4��ŨHNO3�Ļ���ʱ��Ӧ��H2SO4�����ӵ�ŨHNO3�У�����ʱ�������ȴ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com