
【题目】在下列平衡体系中,保持温度一定时,改变某一物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是( )
A. 2NO+O2![]() 2NO2 B. Br2(g)+H2
2NO2 B. Br2(g)+H2 ![]() 2HBr
2HBr
C. N2O4 ![]() 2NO2 D. 6NO+4NH3
2NO2 D. 6NO+4NH3 ![]() 5N2+3H2O
5N2+3H2O
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】下列仪器中,可直接用酒精灯加热的是( )
①烧杯;②坩埚;③锥形瓶;④蒸发皿;⑤试管;⑥圆底烧瓶;⑦容量瓶
A. ②④⑤ B. ①②⑤⑥ C. ②④⑥⑦ D. ①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,体系中n(CO)随时间的变化如下表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示CH3OH的变化的曲线是_______。

(2)用H2表示从0~2s内该反应的平均速率v(H2)=___________________。
(3)该反应达到最大限度时CO的转化率为___________。
(提示:转化率=![]() ×100%)
×100%)
(4)能说明该反应已达到平衡状态的是______。
a. CO与H2的浓度保持不变 b. 容器内密度保持不变
c. 容器内压强保持不变 d. 每消耗1molCH3OH的同时有2mol H–H形成
(5)CH3OH与O2的反应可将化学能转化为电能,其工作原理如下图所示,图中CH3OH从______(填A或B)通入。
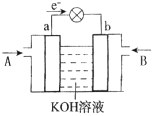
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下, 2SO2+O2![]() 2SO3(正反应放热)已达平衡,保持其它条件不变,只改变其中一个条件,v(正)、v(逆)的变化如图所示。下列判断正确的是 ( )
2SO3(正反应放热)已达平衡,保持其它条件不变,只改变其中一个条件,v(正)、v(逆)的变化如图所示。下列判断正确的是 ( )
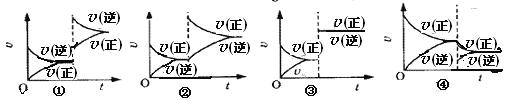
A. ①图可能是由于加压、使容器体积减小引起的
B. ②图可能是升高温度引起的
C. ③图可能是加压、缩小容器体积引起的
D. ④图是只减少了SO3的浓度引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境密切相关,下列说法正确的是( )
A.CO2属于大气污染物B.酸雨是pH小于7的雨水
C.将电器垃圾深埋处理,可减少重金属污染D.大雾是一种胶体,能发生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在298K、100kPa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)列式近似计算该反应在298K的平衡常数___________。
(2)如果增大氯气的压强,平衡将向______________移动。
Ⅱ、甲酸甲酯水解反应方程式为:HCOOCH3(1)+H2O(1)![]() HCOOH(l)+CH3OH(1) △H>0
HCOOH(l)+CH3OH(1) △H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(3)请计算15~20min范围内甲酸甲酯的减少量为____________________mol
(4)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
反应时间 / min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 60~65 |
平均反应速率 /(10-3mol·min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
依据以上数据,出该反应的反应速率在不同阶段的变化规律:________,其原因是:_________ 。
(5)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L容器中放入2molA和2molB,一定条件下发生反应:aA(s)+bB(g)![]() dD(g)+eE(g)(放热反应),5分钟后达到平衡,平衡时B的转化率为50%,
dD(g)+eE(g)(放热反应),5分钟后达到平衡,平衡时B的转化率为50%,
(1)若从反应开始,甲同学控制恒温恒容,乙同学控制恒温恒压,且b >d+e ,则平衡时B的转化率甲____乙(填“大于”、“小于”或“等于”)
(2)若从反应开始,甲同学控制恒温恒容,乙同学控制恒容绝热,则平衡时B的转化率:甲___乙。(填“大于”、“小于”或“等于”)
(3)若控制恒温恒容,反应达到平衡后,混合气体的密度比反应未达平衡前 _____(填“增大”、“不变”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mA(气) + nB(气) ![]() pC(气) + qD(气)的 C % 与时间t有如图关系
pC(气) + qD(气)的 C % 与时间t有如图关系
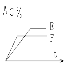
(1)若E、F表示两种温度,则 E____F ( 填 > 、< 或 = ),正反应____ 热
(2)若E、F表示两种压强,则 m + n_____p + q ( 填 > 、< 或 = )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是

A. 石墨电极Ⅱ处的电极反应式为O2+4e-===2O2-
B. X是铁电极
C. 电解池中的电解液为蒸馏水
D. 若将电池两极所通气体互换,X、Y两极材料也互换,实验方案更合理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com