
【题目】如图为铁及其化合物的“价-类”二维图。

(1)填写二维图缺失的类别①___和化学式②___。
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:
①Cl2 ②Fe ③NaOH ④H2SO4 ⑤AgNO3
从物质类别上看,FeCl3属于___,可能与___发生反应(填序号);
从化合价角度看,Fe3+具有___性,可能与___发生反应(填序号)。
(3)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路,其化学原理为如下反应:Cu+2FeCl3=CuCl2+2FeCl2
①用单线桥表示电子转移。___。
②反应中FeCl3作___剂,理由是___。
③写出该反应的离子方程式___。
【答案】单质 Fe(OH)3 盐 ③⑤ 氧化 ② ![]() 氧化 铁的化合价由正三价变为正二价 Cu+2Fe3+=Cu2++2Fe2+
氧化 铁的化合价由正三价变为正二价 Cu+2Fe3+=Cu2++2Fe2+
【解析】
(1)将物质与名称对应,即可得到①和②;
(2)FeCl3属于盐,铁元素处于最高价态,可发生还原反应;据此回答问题;
(3)反应Cu+2FeCl3=CuCl2+2FeCl2为氧化还原反应,Cu失电子,化合价升高,发生氧化反应,作还原剂;Fe元素化合价由+3价降低到+2价,得电子,化合价降低,发生还原反应,FeCl3作氧化剂,据此回答问题;
(1)Fe为金属单质,则①为单质;铁的氢氧化物有Fe(OH)2和Fe(OH)3两种,则②为Fe(OH)3;
(2)从物质类别上看,FeCl3属于盐,可能与氢氧化钠和硝酸银反应;从化合价角度看,Fe3+化合价处于最高价态,具有氧化性,可发生还原反应,可能与铁发生反应;
(3)反应Cu+2FeCl3=CuCl2+2FeCl2为氧化还原反应,Cu失电子,化合价升高,发生氧化反应,作还原剂;Fe元素化合价由+3价降低到+2价,得电子,化合价降低,发生还原反应,FeCl3作氧化剂,
①用单线桥表示电子转移为:![]() ;
;
②反应中FeCl3中Fe元素化合价由+3价降低到+2价,得电子,化合价降低,发生还原反应,作氧化剂;
③反应的离子方程式为:Cu+2Fe3+=Cu2++2Fe2+。


科目:高中化学 来源: 题型:
【题目】乙烯、丙烯等低碳烯烃是重要的基本化工原料,随着我国国民经济的发展,对低碳烯烃的需求日渐攀升。回答下列问题:
(1)MTP(甲醇制丙烯)工艺是目前重要的化工技术。主反应为![]()
![]() 。反应历程可按下列催化过程进行:
。反应历程可按下列催化过程进行:
![]()
![]() 则
则![]() =___________。
=___________。
(2)MTP工艺中存在等多个副反应。其他条件都相同时,在某催化剂的作用下,反应温度对甲醇转化率和产物选择性的影响如图所示。已知:
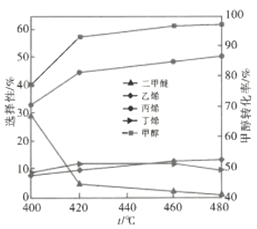
①主、副反应均为放热反应,且均为有水蒸气生成的气体分子数增加的反应
②选择性=(生成目的产物所消耗的原料量/转化掉的原料量)×100%
据图分析,若欲显著提高乙烯的选择性,不宜采取的措施是___________(填“改变温度”或“改变催化剂”);图中温度低于480℃时甲醇的转化率___________(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是___________;下列措施中可提高甲醇平衡转化率的是___________(填标号)。
A.增大甲醇浓度
B.减小压强
C.用干燥剂吸收水蒸气
D.减小反应的平衡常数
(3)恒容条件下,若反应温度为460℃,![]() 初始浓度为
初始浓度为![]() mol
mol![]() ,平衡转化率为
,平衡转化率为![]() ,丙烯的选择性为48.3%,水蒸气的平衡浓度为
,丙烯的选择性为48.3%,水蒸气的平衡浓度为![]() ,则丙烯的平衡浓度为_____________,主反应
,则丙烯的平衡浓度为_____________,主反应![]() 的平衡常数K(460℃)的计算式为___________。
的平衡常数K(460℃)的计算式为___________。
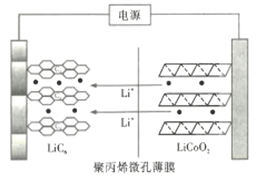
(4)丙烯可用于制备聚丙烯,聚丙烯微孔薄膜可用作锂离子电池的隔膜。某种锂离子电池充电时的示意图如图所示。![]() 中的
中的![]() 穿过隔膜向左迁移并嵌入石墨(用
穿过隔膜向左迁移并嵌入石墨(用![]() 表示)中。放电时
表示)中。放电时![]() 中的
中的![]() 又脱嵌向右迁移,则该电池放电时负极的电极反应式为___________。
又脱嵌向右迁移,则该电池放电时负极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.01 mol的酸性混合溶液中加入0.01 mol铁粉,经搅拌后发生的变化应是 ( )
A. 铁溶解,析出0.01 mol Ag和0.005 mol Cu
B. 铁溶解,析出0.01 mol Ag并放出H2
C. 铁溶解,析出0.01 mol Ag,溶液中不再有Fe3+
D. 铁溶解,析出0.01 mol Ag,溶液中不再有Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是一个简易测量物质反应是吸热反应还是放热反应的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
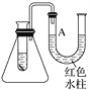
(1)有关反应的离子方程式是_________________________________________,
试管中看到的现象是________________________________________。
(2)U形管中液面A________(填“上升”或“下降”),原因是__________________;
说明此反应是________(填“放热”或“吸热”)反应。
(3)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:

(1) KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列_____物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.“84”消毒液(NaClO溶液)
(2)操作Ⅰ的名称是________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________ (填性质)上差异,采用 __________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
(3)上述流程中可以循环使用的物质有石灰、CO2、____和____ (写化学式)。
(4) 向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是_______。
(5) 铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:__________________。
(6) 写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:________________。
(7)若不考虑物质循环与制备过程中的损失,则1mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用盐酸标准液滴定未知浓度的NaOH溶液,下列各操作中会引起实验误差的是( )
A. 滴定前酸式滴定管需用盐酸标准液润洗
B. 用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定
C. 往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定
D. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素在生物体内的含量分布情况,下列表述不正确的是( )
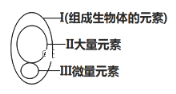
A. Ⅰ在非生物界中都能找到,体现了生物界与非生物界的统一性
B. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. P、S、K、Ca、Zn属于大量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用黄铜矿(主要成分是CuFeS2,其中S为-2价)为主要原料炼铜,其总反应为:2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2。事实上该反应是按如下流程分步进行的:
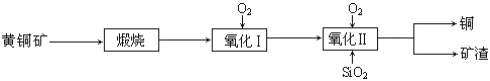
(1)氧化Ⅰ的反应主要是煅烧生成的硫化亚铁被进一步氧化为氧化亚铁,并与二氧化硅反应生成矿渣。矿渣的主要成分是(填化学式)_____________________。
(2)据报道,有一种细菌在氧气存在下可以将黄铜矿氧化成硫酸盐,反应是在酸性溶液中发生的。该反应的化学方程式为____________________。
(3)我国学者研究发现,以精CuFeS2矿为原料在沸腾炉中与O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,生产成本能够降低许多。有关实验结果如下表:
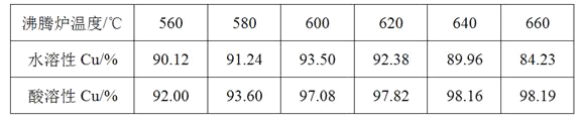
①CuFeS2与O2反应的化学方程式为______________________。
②实际生产过程中沸腾炉温度为600~620 ℃。则控制温度的方法是_______________。
③当温度高于600~620 ℃时,生成物中水溶性铜下降的原因是____________。
④生成物冷却后的除铁的实验操作方法主要是_________。已知在溶液中,Cu2+开始沉淀和沉淀完全的pH分别为4.7、6.7,Fe3+开始沉淀和沉淀完全的pH分别为1.1、3.2;如果制得的硫酸铜溶液中含有少量的Fe3+,请写出除去溶液中Fe3+的实验操作步骤:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com