
【题目】在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3molN气体混合,发生如下反应:![]()
![]() ,该反应达平衡时,生成
,该反应达平衡时,生成![]() R,并测得Q的浓度为
R,并测得Q的浓度为![]() ,下列有关叙述正确的是
,下列有关叙述正确的是![]()
A.x值为2B.混合气体的密度增大
C.平衡时N的浓度为![]()
![]() D.N的转化率为
D.N的转化率为![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有__________________(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是______________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 molL-1,滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05 molL-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是______________。
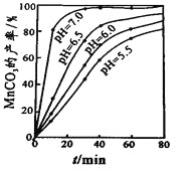
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是______________________。
(6)从沉锰工序中得到纯净MnCO3的操作方法是___________________。副产品A的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为![]() L的密闭容器内,物质D在
L的密闭容器内,物质D在![]() 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是
时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是
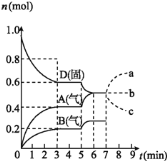
A.从反应开始到第一次达到平衡时,B物质的平均反应速率为![]()
![]()
B.根据如图该反应的平衡常数表达式为![]()
C.若在第5min时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大
D.若在第7分钟时增加D的物质的量,A的物质的量变化情况符合a曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:![]() 的数据如图所示,
的数据如图所示,

下列说法正确的是( )
A.该反应的![]()
B.达平衡时,![]()
C.b点对应的平衡常数K值大于c点
D.a点对应的![]() 的平衡转化率为
的平衡转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3和O2在一定条件下发生反应:4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后反应达到平衡,测得生成的H2O(g)占混合气体总体积的40%,则下列表示的此段时间内该反应的平均速率不正确的是( )
2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后反应达到平衡,测得生成的H2O(g)占混合气体总体积的40%,则下列表示的此段时间内该反应的平均速率不正确的是( )
A. v(N2)=0.125 mol·L-1·min-1B. v(H2O)=0.375 mol·L-1·min-1
C. v(O2)=0.225 mol·L-1·min-1D. v(NH3)=0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片 5.0g 投入盛有500mL 0.5mol·L-1硫酸溶液的 烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表 示,回答下列问题:
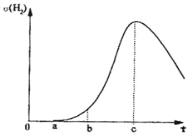
(1).曲线由 O→a 段不产生氢气的原因_________________________________________________用离子方程式表示)
(2).曲线由 a→b 段产生氢气的速率较慢的原因_______________________________________________。
(3).曲线由 b→c 段,产生氢气的速率增加较快的主要原因_____。
(4).曲线由 c 以后,产生氢气的速率逐渐下降的主要原因_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的醋酸,某学生用0.1000 mol·L-1 NaOH标准溶液进行测定醋酸的浓度的实验,取20.00mL待测醋酸放入锥形瓶中,并滴加2~3滴指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:
实验编号 | 待测醋酸的体积/mL | NaOH溶液的浓度/mol·L-1 | 消耗NaOH溶液的体积/mL |
1 | 20.00 | 0.1000 | 25.18 |
2 | 20.00 | 0.1000 | 23.06 |
3 | 20.00 | 0.1000 | 22.98 |
(1)该实验中指示剂最好选用___________,滴定达到终点的标志是_____________________。
(2)排除碱式滴定管尖嘴中气泡的方法应采用以下_________操作(填甲/乙/丙),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)根据上述数据,可计算出该醋酸的浓度为_________mol·L-1(保留小数点后4位)。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________。
A.用滴定管取20.00mL待测醋酸,使用前,水洗后未用待测醋酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会发展等息息相关,下列说法正确的是![]()
![]()
A.变色眼镜“光致变色”,是因为掺进了微量光敏感物质![]() 如溴化银
如溴化银![]()
B.日常生活中,卤水点豆腐、花生中提取花生油、硬水软化都是物理变化
C.制肥皂时,在皂化液里加入饱和食盐水,不能促进高级脂肪酸钠的析出
D.聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com