
【题目】一定条件下,反应:![]() 的数据如图所示,
的数据如图所示,

下列说法正确的是( )
A.该反应的![]()
B.达平衡时,![]()
C.b点对应的平衡常数K值大于c点
D.a点对应的![]() 的平衡转化率为
的平衡转化率为![]()
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
a.配制![]() 食盐溶液时,将称量的食盐放入烧杯中,加适量的水,搅拌、溶解
食盐溶液时,将称量的食盐放入烧杯中,加适量的水,搅拌、溶解
b.用50mL量筒量取![]() 稀硫酸
稀硫酸
c.用中和滴定法测定某NaOH溶液的浓度时,酸式滴定管需用标准酸液润洗![]() 次
次
d.配制![]() 的
的![]() 溶液时,将量取的浓
溶液时,将量取的浓![]() 注入容量瓶中加水稀释
注入容量瓶中加水稀释
e.用瓷坩埚灼烧各种钠的化合物
f.测定中和反应的反应热时,利用玻璃搅拌器匀速搅拌.
A.adfB.bdeC.acfD.cef
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐类水解的说法错误的是( )
A.等温下,物质的量浓度相等的①NaHCO3、②Na2CO3、③NaOH溶液的pH大小:③ > ② > ①
B.浓度均为0.1mol/L的 ①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:① > ② > ③
C.在NH4Cl溶液中加入稀HNO3,能抑制NH4+水解
D.在CH3COONa溶液中加入冰醋酸,能抑制CH3COO-水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A2+3B2![]() 2AB3 以下表示的反应速率中,速率最大的是( )
2AB3 以下表示的反应速率中,速率最大的是( )
A. V(A2)=0.4 molL-1min-1 B. V(B2)=0.8 molL-1min-1
C. V(AB3)=0.6 molL-1min-1 D. V(A2)=0.01 molL-1S-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3molN气体混合,发生如下反应:![]()
![]() ,该反应达平衡时,生成
,该反应达平衡时,生成![]() R,并测得Q的浓度为
R,并测得Q的浓度为![]() ,下列有关叙述正确的是
,下列有关叙述正确的是![]()
A.x值为2B.混合气体的密度增大
C.平衡时N的浓度为![]()
![]() D.N的转化率为
D.N的转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展储氢技术是氢氧燃料电池推广应用的关键.研究表明液氨是一种良好的储氢物质,其储氢容量可达![]()
![]() 质量分数
质量分数![]() 液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:
液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.氨气分解反应的热化学方程式如下:![]()
请回答下列问题:
![]() 氨气自发分解的反应条件是 ______ .
氨气自发分解的反应条件是 ______ .
![]() 已知:
已知:![]()
![]()
![]()
![]()
则,反应![]()
![]() 的
的![]() ______ .
______ .
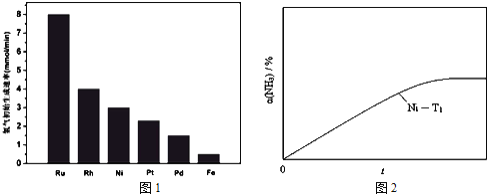
![]() 研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
研究表明金属催化剂可加速氨气的分解.图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率.
①不同催化剂存在下,氨气分解反应的活化能最大的是 ______ ![]() 填写催化剂的化学式
填写催化剂的化学式![]() .
.
②恒温![]() 恒容时,用Ni催化分解初始浓度为
恒容时,用Ni催化分解初始浓度为![]() 的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率
的氨气,并实时监测分解过程中氨气的浓度.计算后得氨气的转化率![]() 随时间t变化的关系曲线
随时间t变化的关系曲线![]() 如图
如图![]() 请在图2中画出:在温度为
请在图2中画出:在温度为![]() ,Ru催化分解初始浓度为
,Ru催化分解初始浓度为![]() 的氨气过程中
的氨气过程中![]() 随t变化的总趋势曲线
随t变化的总趋势曲线![]() 标注
标注![]() ______
______
③如果将反应温度提高到![]() ,请如图2中再添加一条Ru催化分解初始浓度为
,请如图2中再添加一条Ru催化分解初始浓度为![]() 的氨气过程中
的氨气过程中![]() 的总趋势曲线
的总趋势曲线![]() 标注
标注![]() ______
______
④假设Ru催化下温度为![]() 时氨气分解的平衡转化率为
时氨气分解的平衡转化率为![]() ,则该温度下此分解反应的平衡常数K与
,则该温度下此分解反应的平衡常数K与![]() 的关系式是:
的关系式是:![]() ______ .
______ .
![]() 用Pt电极对液氨进行电解也可产生
用Pt电极对液氨进行电解也可产生![]() 和
和![]() 阴极的电极反应式是 ______ ;阳极的电极反应式是 ______
阴极的电极反应式是 ______ ;阳极的电极反应式是 ______ ![]() 已知:液氨中
已知:液氨中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福特公司发明的硫钠电池是一种以金属钠为负极、硫为正极、陶瓷管为电解质隔膜(作用是传递Na+)的二次电池,其原理可以表示为2Na+xS![]() Na2Sx。现将该电池用于电浮选凝聚法对污水进行处理,电源两极分别连接Fe电极和石墨电极,对污水进行处理后,溶液上层有大量的浮渣。下列有关说法错误的是
Na2Sx。现将该电池用于电浮选凝聚法对污水进行处理,电源两极分别连接Fe电极和石墨电极,对污水进行处理后,溶液上层有大量的浮渣。下列有关说法错误的是

A. 硫钠电池放电时正极反应方程式可表示为:xS+2e-+2Na+=Na2Sx
B. Fe电极为电解池阳极,失电了生成亚铁离子,最终会转化为三价铁形成氢氧化铁胶体从而达到净水目的
C. 处理污水时阴极产生的气体可将水中的悬浮物带到水面形成浮渣层,即浮选凝聚
D. 硫钠电池充电时钠离子向阴极移动,每生成1molNa转移xmol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH=-QkJ·mol1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是

A. 图Ⅰ研究的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ研究的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com