
【题目】下列关于盐类水解的说法错误的是( )
A.等温下,物质的量浓度相等的①NaHCO3、②Na2CO3、③NaOH溶液的pH大小:③ > ② > ①
B.浓度均为0.1mol/L的 ①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:① > ② > ③
C.在NH4Cl溶液中加入稀HNO3,能抑制NH4+水解
D.在CH3COONa溶液中加入冰醋酸,能抑制CH3COO-水解
【答案】B
【解析】
①NaHCO3和②Na2CO3溶液中酸根离子水解显碱性,碳酸氢根离子水解程度小于碳酸根离子水解程度,③NaOH溶液是强碱完全电离,碱性越强pH越大; ①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2 都含有两个NH4+,(NH4)2CO3 中CO32-促进NH4+水解,(NH4)2Fe(SO4)2中Fe2+抑制NH4+水解,据此解答;氯化铵溶液中铵根离子水解溶液显酸性,加入硝酸抑制铵根离子水解;醋酸钠溶液中醋酸根离子水解溶液显碱性,加入冰醋酸溶解后醋酸根离子浓度增大,水解程度减小。
A、碱性越强,pH越大,①为多元弱酸酸式盐,②为多元弱酸正盐,③为强碱,则pH的大小顺序是③>②>①,故A正确;
B、(NH4)2CO3 中CO32-促进NH4+水解,(NH4)2Fe(SO4)2中Fe2+抑制NH4+水解,因此相同浓度的这几种溶液中铵根离子浓度大小顺序是③>②>①,故B错误;
C、在NH4Cl溶液中铵根离子水解溶液显酸性,NH4++H2O![]() NH3H2O+H+,加入稀HNO3,氢离子浓度增大能抑制NH4+水解,故C正确;
NH3H2O+H+,加入稀HNO3,氢离子浓度增大能抑制NH4+水解,故C正确;
D、醋酸钠溶液中醋酸根离子水解溶液显碱性,加入冰醋酸醋酸根离子浓度增大,水解程度减小,能抑制CH3COO-水解,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 100g质量分数为 46%C2H5OH溶液中所含O—H数目约为7NA
B. 质量为12g的12C含有的中子数为12NA
C. 将0.1molCH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目小于0.1NA
D. 氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验(a、b两电极均为Cu单质),实验开始观察到灵敏电流计的指针偏转,下列有关说法正确的是( )

A.a极电极反应为Cu2++2e-=CuB.溶液中Cu2+穿过交换膜发生迁移
C.电流计指针偏转幅度将保持不变D.外电路转移的电子最多为0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有__________________(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是______________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 molL-1,滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05 molL-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是______________。
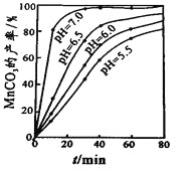
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是______________________。
(6)从沉锰工序中得到纯净MnCO3的操作方法是___________________。副产品A的化学式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A.H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B.NaHCO3在水溶液中的电离方程式:NaHCO3===Na++H++CO32-
C.NaHSO4在水溶液中的电离方程式:NaHSO4===Na++HSO42-
D.NaHSO4在熔融状态的电离方程式:NaHSO4===Na++H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为![]() L的密闭容器内,物质D在
L的密闭容器内,物质D在![]() 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是
时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是
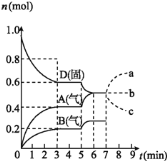
A.从反应开始到第一次达到平衡时,B物质的平均反应速率为![]()
![]()
B.根据如图该反应的平衡常数表达式为![]()
C.若在第5min时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大
D.若在第7分钟时增加D的物质的量,A的物质的量变化情况符合a曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:![]() 的数据如图所示,
的数据如图所示,

下列说法正确的是( )
A.该反应的![]()
B.达平衡时,![]()
C.b点对应的平衡常数K值大于c点
D.a点对应的![]() 的平衡转化率为
的平衡转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片 5.0g 投入盛有500mL 0.5mol·L-1硫酸溶液的 烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表 示,回答下列问题:
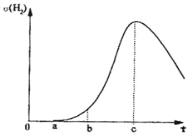
(1).曲线由 O→a 段不产生氢气的原因_________________________________________________用离子方程式表示)
(2).曲线由 a→b 段产生氢气的速率较慢的原因_______________________________________________。
(3).曲线由 b→c 段,产生氢气的速率增加较快的主要原因_____。
(4).曲线由 c 以后,产生氢气的速率逐渐下降的主要原因_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片插入同浓度的稀硫酸中一段时间,下列叙述正确的是![]()

A.甲中铜片是正极,乙中铜片是负极
B.甲中铜被氧化,乙中锌被氧化
C.甲中锌片上的反应为:![]()
D.两烧杯中铜片表面均无气泡产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com