
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有__________________(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是______________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 molL-1,滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕,
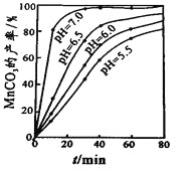
(4)沉锰工序中,298K、c(Mn2+)为1.05 molL-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是______________。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是______________________。
(6)从沉锰工序中得到纯净MnCO3的操作方法是___________________。副产品A的化学式是________。
【答案】 搅拌、适当升高温度、研磨矿石、适当提高稀硫酸的浓度 使残余的Fe2+转化为Fe3+ 1.46×10-6molL-1 pH等于7.0时反应速率最快,且MnCO3的产率最高 Mn2++2HCO3-= MnCO3↓+CO2↑+H2O 过滤、洗涤、干燥 (NH4)2SO4
【解析】本题分析:本题主要考查对于“制备高性能磁性材料碳酸锰(MnCO3)的工业流程”的评价。
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有搅拌、适当升高温度、研磨矿石、适当提高稀硫酸的浓度等。
(2) Fe3+比Fe2+容易转化为沉淀,所以加入适量的软锰矿,其作用是使残余的Fe2+转化为Fe3+。
(3) Ksp(CaF2)=c(Ca2+)c2(F-)=1.46×10-10,将c(F-)=0.01 molL-1代入,可得c(Ca2+)=1.46×10-6molL-1。
(4)根据图中信息得出的结论是pH等于7.0时反应速率最快,且MnCO3的产率最高。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是Mn2++2HCO3-= MnCO3↓+CO2↑+H2O。
(6)从沉锰工序中得到纯净MnCO3的操作方法是过滤、洗涤、干燥。副产品A的化学式是(NH4)2SO4。


科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
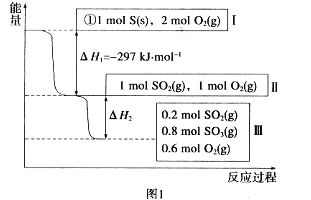
(1)在恒温,容积为1 L容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
①写出能表示硫的燃烧热的热化学方程式: _____________________________
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为___________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年单位GDP二氧化碳排放比2005年下降40%~50% 。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________
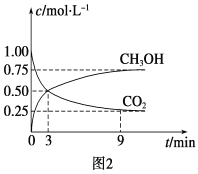
②能说明上述反应达到平衡状态的是______(填编号)
A、反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B、混合气体的密度不随时间的变化而变化
C、CO2的体积分数在混合气体中保持不变
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度B.缩小容器体积C.再充入CO2气体D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,能用勒夏特列原理解释的是
A.配制FeSO4溶液时,加入一些铁粉
B.500℃左右比室温更有利于合成氨的反应
C.实验室常用排饱和食盐水的方法收集氯气
D.由H2、I2(g)、HI组成的平衡体系,加压后颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向足量的饱和Na2CO3溶液中加入1.06g无水Na2CO3,充分搅拌后静置,最终所得晶体(Na2CO310H2O)的质量 ( )
A. 等于1.06g B. 大于1.06g而小于2.86g C. 等于2.86g D. 大于2.86g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入CO和![]() 各
各![]() mol,一定温度下发生反应:
mol,一定温度下发生反应:![]() ,下列叙述正确的是
,下列叙述正确的是
A.如果容器内压强不再改变,则证明该反应已达到平衡状态
B.寻找合适的催化剂是加快反应速率并提高![]() 产率的有效措施
产率的有效措施
C.当反应达到平衡后,保持容器内体积不变,再向其中充入CO和![]() 各1mol,达到新的平衡后
各1mol,达到新的平衡后![]() 的产率会增大
的产率会增大
D.如果在某温度下平衡常数为![]() ,则平衡时CO转化率为
,则平衡时CO转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于盐类水解的说法错误的是( )
A.等温下,物质的量浓度相等的①NaHCO3、②Na2CO3、③NaOH溶液的pH大小:③ > ② > ①
B.浓度均为0.1mol/L的 ①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:① > ② > ③
C.在NH4Cl溶液中加入稀HNO3,能抑制NH4+水解
D.在CH3COONa溶液中加入冰醋酸,能抑制CH3COO-水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3molN气体混合,发生如下反应:![]()
![]() ,该反应达平衡时,生成
,该反应达平衡时,生成![]() R,并测得Q的浓度为
R,并测得Q的浓度为![]() ,下列有关叙述正确的是
,下列有关叙述正确的是![]()
A.x值为2B.混合气体的密度增大
C.平衡时N的浓度为![]()
![]() D.N的转化率为
D.N的转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
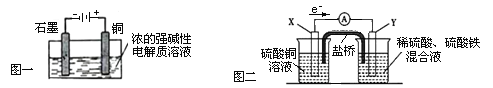
A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应
B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成
C.图二装置中发生:Cu+2Fe3+ = Cu2+ +2Fe2+ ,X极是负极,Y极材料可以是铜
D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+ 经过盐桥进入左侧烧杯中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com