
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
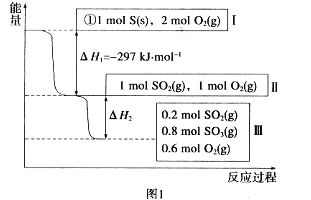
(1)在恒温,容积为1 L容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
①写出能表示硫的燃烧热的热化学方程式: _____________________________
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为___________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年单位GDP二氧化碳排放比2005年下降40%~50% 。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________
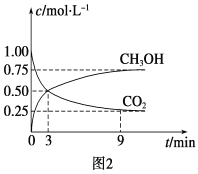
②能说明上述反应达到平衡状态的是______(填编号)
A、反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B、混合气体的密度不随时间的变化而变化
C、CO2的体积分数在混合气体中保持不变
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度B.缩小容器体积C.再充入CO2气体D.使用合适的催化剂
【答案】S(s)+O2(g)![]() SO2(g) ΔH=-297 kJ·mol-1 -78.64 20% 吸收 19.66 0.125 16/3 CD B
SO2(g) ΔH=-297 kJ·mol-1 -78.64 20% 吸收 19.66 0.125 16/3 CD B
【解析】
(1)①燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
②焓变与化学计量数有关;
③当充入1mol SO3,0.5mol O2时,相当于充入1mol SO2和1mol O2,和原平衡等效,据此分析;
(2)①根据速率公式计算速率;用三行式分析平衡时浓度,根据平衡常数表达式计算平衡常数;
②根据平衡状态判断方法判断是否达到平衡;
③根据平衡移动方向,分析改变的条件。
(1)①S燃烧生成SO2,所以对应的焓变为ΔH1,则表示硫的燃烧热的热化学方程式为S(s)+O2(g)![]() SO2(g) ΔH=-297 kJ·mol-1;
SO2(g) ΔH=-297 kJ·mol-1;
故答案为:S(s)+O2(g)![]() SO2(g) ΔH=-297 kJ·mol-1;
SO2(g) ΔH=-297 kJ·mol-1;
②根据反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1,2molSO2完全转化,放热196.6kJ,从图可知有0.8molSO2发生转化,则ΔH2=
2SO3(g) ΔH=-196.6 kJ·mol-1,2molSO2完全转化,放热196.6kJ,从图可知有0.8molSO2发生转化,则ΔH2=![]() ×0.8mol=-78.64kJ/mol;
×0.8mol=-78.64kJ/mol;
故答案为:-78.64;
③当充入1mol SO3,0.5mol O2时,相当于充入1mol SO2和1mol O2,和原平衡等效,所以SO3的转化率为(1-![]() )×100%=20%,此时反应要吸收热量,其热量为
)×100%=20%,此时反应要吸收热量,其热量为![]() -78.64 kJ=19.66kJ;
-78.64 kJ=19.66kJ;
故答案为:20%;吸收;19.66;
(2)①v(H2)=3v(CO2)=3![]() =0.125 mol·L-1·min-1;
=0.125 mol·L-1·min-1;
根据图2信息可以知道:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始浓度(mol/L): 1 3 0 0
变化浓度(mol/L):0.75 2.25 0.75 0.75
平衡浓度(mol/L):0.25 0.75 0.75 0.75
平衡常数为K=![]() =
=![]() =16/3;
=16/3;
故答案为:0.125;16/3;
②A、由图可知反应中CO2与CH3OH的物质的量浓度之比为1:1时,并未达到平衡状态,故A不选;
B、因气体的质量不变,容器的体积不变,则无论是否达到平衡状态,都存在混合气体的密度不随时间的变化而变化,不能判断是否达到平衡状态,故B不选;
C、CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故C选;
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O,用不同物质表示的反应速率之比等于化学计量数之比,说明v(正)=v(逆),说明达到平衡状态,故D选;
综合以上分析,答案选CD。
③为了加快化学反应速率且使体系中气体的物质的量减少,说明要求平衡正向移动,
A.升高温度,平衡逆向移动,故A错误;
B.缩小容器体积,平衡正向移动,故B正确;
C.再充入CO2气体, 平衡正向移动,但气体的物质的量增大,故C错误;
D.使用合适的催化剂,平衡不移动,故D错误。
故答案为:B。


科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,通入HCl可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 molB.3.2 molC.2.8 molD.1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)镉镍可充电电池在现代生活中有广泛应用,已知某镍镉电池的电解质溶液为KOH溶液,它的充、放电反应按下式进行:
Cd + 2NiO(OH) + 2H2O![]() Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
由此可知,该电池放电时的正极反应式为__________________,放电时负极附近溶液的碱性___________(填“增强”、“减弱”或“不变”)。该电池充电时,阳极上发生的是__________反应(填“氧化”或“还原”)。
(2)如图为相互串联的甲、乙两个电解池,试回答下列问题:

①甲池若为用电解原理精炼铜的装置,A极是电解池的____________,材料是_________;电极反应式为______________________。
②若甲池阴极增重19.2 g,则乙池阳极放出气体在标准状况下的体积为__________L(不考虑气体的溶解情况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.4.0 g由CO2和SO2组成的混合物中含有的质子数为2NA
B.2.24 L Cl2与CH4在光照下反应生成的HCl分子数为0.1NA
C.0.1 mol/L K2S溶液中含有的K+数为0.2NA
D.4.2 g CaH2与水完全反应,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 100g质量分数为 46%C2H5OH溶液中所含O—H数目约为7NA
B. 质量为12g的12C含有的中子数为12NA
C. 将0.1molCH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目小于0.1NA
D. 氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有__________________(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是______________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 molL-1,滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕,
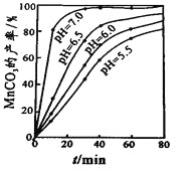
(4)沉锰工序中,298K、c(Mn2+)为1.05 molL-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是______________。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是______________________。
(6)从沉锰工序中得到纯净MnCO3的操作方法是___________________。副产品A的化学式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com