
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
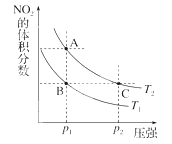
A.若恒温恒容时充入氩气,平衡向逆反应方向移动。
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.因为B、C两点NO2的体积分数相同,所以化学平衡常数KB = KC
科目:高中化学 来源: 题型:
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能检验出一定存在的离子是( )
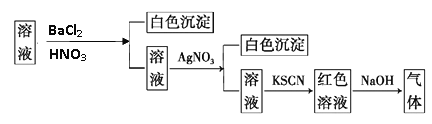
A. SO42-、NH4+ B. Cl- C. Fe3+ D. NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学,是研究物质的性质的重要途径。某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
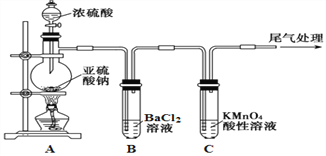
已知:Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O,请回答下列问题:
Na2SO4+SO2↑+H2O,请回答下列问题:
(1) 装置A中盛放浓硫酸的仪器名称是__________________。
(2) 实验过程中,C中的现象是____________,说明SO2具有_________性。
(3) 实验过程中,观察到装置B中出现了明显的白色沉淀。为探究该白色沉淀的成分,该小组同学进行了如下实验:
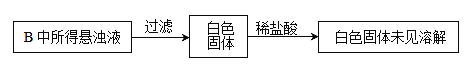
根据实验事实判断该白色沉淀的成分是_______________(填化学式),产生该白色沉淀的原因可能是_____________(填字母编号)。
a.BaSO3既不溶于水也不溶于酸
b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH
d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3,对此实验是否有影响并说明理由_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.增大反应物浓度可增大活化分子百分数,所以反应速率增大
B.放热反应的反应速率一定大于吸热反应的反应速率
C.反应NH3(g) + HCl(g)![]() NH4Cl(s)在室温下可自发进行,则该反应的△H<0
NH4Cl(s)在室温下可自发进行,则该反应的△H<0
D.对于反应X(s)+aY(g)![]() bZ(g)+W(g) △H>0,升高温度,正反应速率增大,逆反应速率减小
bZ(g)+W(g) △H>0,升高温度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
回答下列问题:
(1)下列反应不能发生的是: ;
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
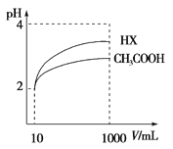
(2)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如右上图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,写出HX的电离方程式 。
(3)某温度下,纯水中c (H+)=2.0×10-7 mol·L1, 0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合后(不考虑溶液体积变化),溶液的pH= 。
(4)等浓度等体积的CH3COONa和NaCN混合后,所得混合溶液中各离子浓度的大小关系是: 。
(5)某二元酸H2B在水中的电离方程式为H2B = H+ + HB— ;HB—![]() H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中发生取代反应的是( )
A.苯与溴水混合,水层褪色
B.乙烯使溴的四氯化碳溶液褪色
C.甲苯制三硝基甲苯
D.苯和氯气在一定条件下生成六氯环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4 ℃,熔点9.79 ℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
填写下列空白:
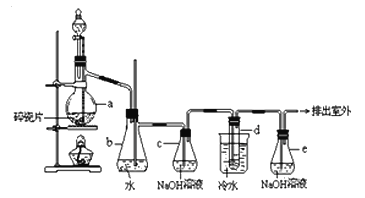
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式: 。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象: 。
(3)容器c中NaOH溶液的作用是: 。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物说法正确的是
A. 乙醇、乙烷和乙酸都可以与钠反应生成氢气
B. 75%(体积分数)的乙醇溶液常用于医疗消毒
C. 苯和乙烯都可使溴的四氯化碳溶液褪色
D. 石油分馏可获得乙酸、苯及其衍生物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C。若维持温度和压强不变,当达到平衡时容器的体积为VL,其中C气体的体积占10%。下列推断正确的是 ( )
2C。若维持温度和压强不变,当达到平衡时容器的体积为VL,其中C气体的体积占10%。下列推断正确的是 ( )
①原混合气体的体积为1.2V L
②原混合气体的体积为1.1V L
③反应达到平衡时气体A消耗掉0.05VL
④反应达平衡时气体B消耗掉0.05V L
A.①③ B.②③ C.①④ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com