
【题目】下列说法正确的是( )
A.增大反应物浓度可增大活化分子百分数,所以反应速率增大
B.放热反应的反应速率一定大于吸热反应的反应速率
C.反应NH3(g) + HCl(g)![]() NH4Cl(s)在室温下可自发进行,则该反应的△H<0
NH4Cl(s)在室温下可自发进行,则该反应的△H<0
D.对于反应X(s)+aY(g)![]() bZ(g)+W(g) △H>0,升高温度,正反应速率增大,逆反应速率减小
bZ(g)+W(g) △H>0,升高温度,正反应速率增大,逆反应速率减小
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
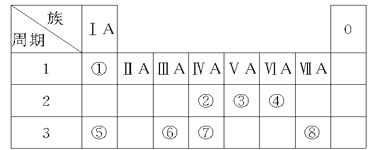
(1)④、⑤、⑥的原子半径由大到小的顺序为(填元素符号)_______。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________。
(3)①、④、⑤三种元素可形成既含离子键又含共价键的化合物,写出该化合物的电子式________。
(4)②的氧化物的结构式_________;比较②、⑦的氧化物的熔点(填化学式):
______>_______,原因是___________________________________________。
(5)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。
①Be(OH)2与Mg(OH)2可用__________鉴别(填名称)。
②写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
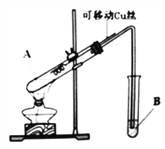
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要的漂白剂。某小组开展如下实验,按如图装置制取无水NaClO2晶体,回答下列问题:
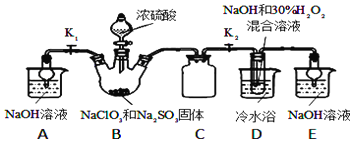
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是_________________;
(2)已知装置B中的产物有ClO2气体,则B中反应的方程式为_________________;装置D中反应生成NaClO2的化学方程式为_________________________;
(3)从装置D反应后的溶液中获得无水NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②____________;③用38℃~60℃热水________;④在_____________条件下干燥得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_________和____________;
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+4I-+4H+═2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32-═2I-+S4O62-).请计算所称取的样品中NaClO2的物质的量为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=0.5 mol·L-1·min-1 B.v(B)=1.2 mol·L-1·s-1
C.v(D)=0.4 mol·L-1·min-1 D.v(C)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识判断以下观点不正确的是
①放热反应不需要任何条件就能进行 ②原电池装置中化学能转化为电能 ③原电池工作时发生的反应一定是氧化还原反应 ④加热时化学反应速率增大 ⑤化学反应达到平衡时反应不再进行
A. ①②④ B. ①⑤ C. ②③⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
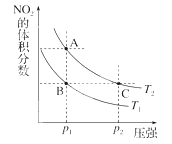
A.若恒温恒容时充入氩气,平衡向逆反应方向移动。
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.因为B、C两点NO2的体积分数相同,所以化学平衡常数KB = KC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.v(D)=0.4 moI/(L·s) B.v(C)=0.5 mol / (L·s)
C.v(B)=0.6 mol / (L·s) D.v(A)=0.15mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com