
【题目】25 ℃时,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
回答下列问题:
(1)下列反应不能发生的是: ;
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
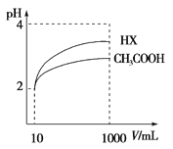
(2)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如右上图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,写出HX的电离方程式 。
(3)某温度下,纯水中c (H+)=2.0×10-7 mol·L1, 0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合后(不考虑溶液体积变化),溶液的pH= 。
(4)等浓度等体积的CH3COONa和NaCN混合后,所得混合溶液中各离子浓度的大小关系是: 。
(5)某二元酸H2B在水中的电离方程式为H2B = H+ + HB— ;HB—![]() H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
【答案】(1)c、d (2)大于 HX![]() H++X— (3)13
H++X— (3)13
(4)C(Na+)> C(CH3COO-)> C(CN-)> C(OH-)> C(H+) (5)酸性
【解析】
试题分析:(1)相同温度、相同浓度时,酸越弱,水解程度越大,强碱盐溶液的pH越大,可知酸性CH3COOH>H2CO3>HClO>HCN>HCO3-,根据强酸制弱酸的原则,下列反应中HClO不能制碳酸、而HClO可与CO32-反应生成HCO3-,故c、d不能发生;
(2)根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大,HX的电离方程式为HX![]() H++X— ;
H++X— ;
(3)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-),过量的c(OH-)=![]() =0.4mol/L,由该温度下的Kw可知,c(H+)=
=0.4mol/L,由该温度下的Kw可知,c(H+)=![]() =10-13molL-1,所以pH=13;
=10-13molL-1,所以pH=13;
(4)等浓度等体积的CH3COONa和NaCN混合后,CN-离子水解程度大于CH3COO-,混合溶液显碱性,
混合溶液中各离子浓度的大小关系是:C(Na+)> C(CH3COO-)> C(CN-)> C(OH-)> C(H+);
(5)某二元酸H2B在水中的电离方程式为H2B =H+ + HB— ;HB—![]() H++ B2-,则NaHB溶液中HB-只电离不水解,溶液一定显酸性。
H++ B2-,则NaHB溶液中HB-只电离不水解,溶液一定显酸性。


科目:高中化学 来源: 题型:
【题目】下列实验装置或操作设计正确、且能达到目的的是
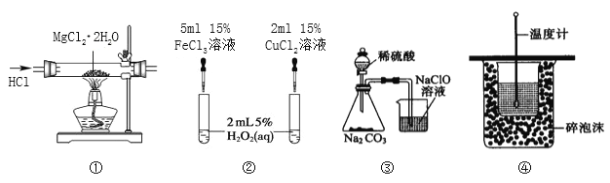
A. 实验①,制取无水MgCl2
B. 实验②,用于比较Fe3+和Cu2+对H2O2分解的催化效果
C. 实验③,验证酸性的强弱,H2SO4>H2CO3>HClO
D. 实验④,进行中和热的测定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
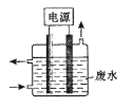
A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
C. 阴极的电极反应式为:2H2O+2e-=H2↑+2OH-
D. 除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=0.5 mol·L-1·min-1 B.v(B)=1.2 mol·L-1·s-1
C.v(D)=0.4 mol·L-1·min-1 D.v(C)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
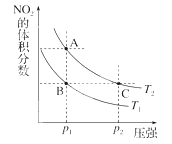
A.若恒温恒容时充入氩气,平衡向逆反应方向移动。
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.因为B、C两点NO2的体积分数相同,所以化学平衡常数KB = KC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案一:2.7g Al![]() X溶液
X溶液![]() Al(OH)3沉淀
Al(OH)3沉淀
方案二:2.7g Al![]() Y溶液
Y溶液![]() Al(OH)3沉淀
Al(OH)3沉淀
NaOH溶液和稀盐酸的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是

A. X溶液溶质为AlCl3,Y溶液溶质为NaAlO2
B. b曲线表示的是向X溶液中加入NaOH溶液
C. 在O点时两方案中所得溶液浓度相等
D. a、b曲线表示的反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿为原料制备铬酸钾(K2Cr2O7)的工艺流程如下图所示。铬铁矿的主要成分可表示为FeO-Cr2O3和杂质SiO2。
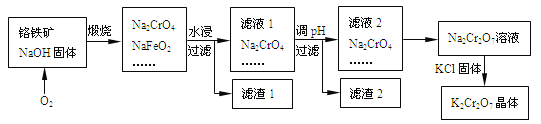
已知:①NaFeO2遇水强烈水解
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
回答下列问题:
(1)K2CrO4中Cr元素的化合价是________。
(2)完成并配平煅烧铬铁矿生成Na2CrO4和NaFeO2的化学反应方程式________
FeO-Cr2O3+ O2+ NaOH![]() Na2CrO4+NaFeO2+ ;
Na2CrO4+NaFeO2+ ;
该反应的氧化产物是________。
(3)生成滤渣1中红褐色物质的化学反应方程式是____________。滤渣2的成分(填化学式)_______。
(4)滤液2存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
A.达到新平衡后,溶液PH一定增大
B.再达到新平衡前,正反应速率一定大于逆反应速率
C.该反应平衡常数可以不改变
D.达新平衡后,CrO42-的消耗速率等于Cr2O72-的消耗速率
(5)含铬废水中含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的危害,必须进行处理。还原沉淀法是常用的一种方法:
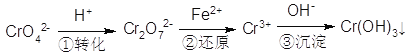
①上述流程中还原过程的离子反应方程式为:_______________。
②最终生成的Cr(OH)3在溶液中存在沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的Ksp=1×10-32,当c(Cr3+)降至1×10-3·mol·L-1,溶液的pH应调至4时______(填“有”或“没有”)沉淀生成。
Cr3+(aq)+3OH—(aq)常温下,Cr(OH)3的Ksp=1×10-32,当c(Cr3+)降至1×10-3·mol·L-1,溶液的pH应调至4时______(填“有”或“没有”)沉淀生成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com