
【题目】下列实验装置或操作设计正确、且能达到目的的是
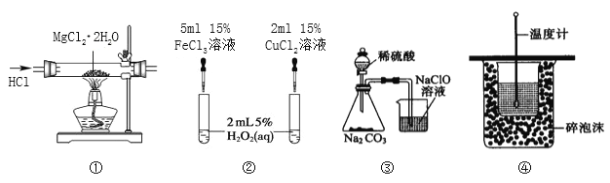
A. 实验①,制取无水MgCl2
B. 实验②,用于比较Fe3+和Cu2+对H2O2分解的催化效果
C. 实验③,验证酸性的强弱,H2SO4>H2CO3>HClO
D. 实验④,进行中和热的测定
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
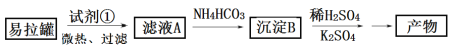
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用无机矿物资源生产部分材料。下列有关说法不正确的是
A.制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO
B.生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应
C.粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法
D.黄铜矿(CuFeS2)冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质除杂(括号内物质为杂质)所用试剂正确的是( )
物 质 | 试 剂 | |
A | Na2SO4溶液(NaBr) | Cl2 |
B | KNO3(NaCl) | AgNO3溶液 |
C | Cl2(HCl) | 饱和食盐水 |
D | CO2(HCl) | 饱和Na2CO3溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水

已知:加热(85℃)NH4Cl和NaNO2饱和溶液可以制取N2
B中仪器名称是___________________;
⑵为了完成实验,装置从左到右接口的连接顺序是_____![]() ______;
______;
⑶D中玻璃纤维的作用是_________________;
⑷小组中甲同学认为F装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是________________________;
II、实验探究
⑸该小组同学利用制备的氨水再进行银镜反应实验。经查阅资料,配制的银氨溶液主要成分是[Ag(NH3)2]OH,小组同学对其组成进行了如下实验探究:
①在洁净的小试管中加入2mL 2%的AgNO3溶液,然后边振荡试管边滴加2%的稀氨水溶液,至最初产生的沉淀恰好溶解为止,制得银氨溶液。
②在制得的银氨溶液中加入无水乙醇,溶液变浑浊,过滤,用__________洗涤,得到白色固体;
③将该白色固体用适量蒸馏水溶解,得到无色溶液,用广范pH试纸检验溶液近似呈中性;向溶液中逐滴加入稀盐酸至不再产生沉淀,静置,取上层清液于另一支放有一小片铜的小试管中并微热,发现铜片的表面有气泡产生,遇到空气变成红棕色;另取少量上层清液加过量的NaOH溶液并加热,得到无色刺激性气体。由此确定通过上述方法制备的白色固体主要成分是___________________;
⑹请根据以上探究,设计实验来制备少量纯净的[Ag(NH3)2]OH溶液:取2mL 2%的AgNO3溶液于洁净的小试管中,_________________,即得到[Ag(NH3)2]OH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能检验出一定存在的离子是( )
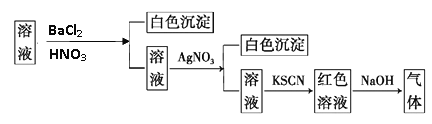
A. SO42-、NH4+ B. Cl- C. Fe3+ D. NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验操作、现象及结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 取1 mL 20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热一段时间后,再滴加银氨溶液 | 没有出现银镜 | 蔗糖没有水解 |
B | 锅炉中的水垢用饱和碳酸钠溶液浸泡后,再加入稀盐酸 | 水垢明显减少 | 锅炉沉积物中的CaSO4转化为CaCO3 |
C | 常温下,在0.1 mol·L1氨水中,加入少量NH4Cl晶体 | 溶液的pH减小 | NH4Cl溶液显酸性 |
D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | NaHCO3为难溶物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合金的说法中错误的是
A. 铝合金中除Al外,还含有Cu、Mg、Si、Zn等
B. 生铁和钢都是铁碳合金
C. 我国在商代就已制造和使用的青铜器其成分主要是Cu-Zn合金
D. 金首饰中常加入一定量的Cu或Ag以增大硬度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
回答下列问题:
(1)下列反应不能发生的是: ;
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
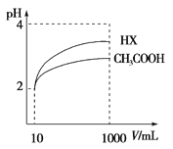
(2)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如右上图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,写出HX的电离方程式 。
(3)某温度下,纯水中c (H+)=2.0×10-7 mol·L1, 0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合后(不考虑溶液体积变化),溶液的pH= 。
(4)等浓度等体积的CH3COONa和NaCN混合后,所得混合溶液中各离子浓度的大小关系是: 。
(5)某二元酸H2B在水中的电离方程式为H2B = H+ + HB— ;HB—![]() H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com