
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。烧杯间填满碎泡沫塑料的作用是________

(2)大烧杯上如不盖硬纸板,求得的中和热数值_______ (填“偏大”、“偏小”或“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”),
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____(填“偏大”“偏小”或“无影响”)。
(5)写出该反应的热化学方程式:____________
【答案】环形玻璃搅拌棒 减少实验过程中的热量损失 偏小 不相等 相等 偏小 H+(aq)+OH-(aq)=H2O(l) △ H=-57.3 kJ/mol
【解析】
(1)中和热的测定须测量酸碱反应的热效应,使用环形玻璃搅拌棒能使溶液上下混合均匀,保证溶液上下的温度达到一致,减少实验误差;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
(2)若大烧杯上不盖硬纸板,会导致热量损失;
(3)改变酸或碱的用量,可以改变反应中放出的热量,但不能改变中和热;
(4)一水合氨为弱碱,在溶液中的电离是一个吸热过程;
(1)中和热的测定须测量酸碱反应的热效应,使用环形玻璃搅拌棒能使溶液上下混合均匀,保证溶液上下的温度达到一致,减少实验误差,所以还缺少环形玻璃搅拌棒;中和热测定实验成败的关键是保温措施,大小烧杯之间填满碎泡沫塑料的作用是减少实验过程中的热量损失,故答案为:环形玻璃搅拌棒;减少实验过程中的热量损失;
(2)中和热测定实验成败的关键是保温措施,若大烧杯上不盖硬纸板,会导致热量损失,使求得的反应热数值偏小,故答案为:偏小;
(3)中和热是在一定条件下,稀溶液中酸和碱反应生成1mol水时放出的热量,若改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行反应,生成水的量增大,放出的热量增大;改变酸或碱的用量,可以改变反应中放出的热量,但不能改变中和热,所测中和热的值依然相等,故答案为:不相等;相等;
(4)一水合氨为弱碱,在溶液中的电离是一个吸热过程,吸热导致测得的中和热数值会偏小,故答案为:偏小;
(5)盐酸和氢氧化钠溶液发生中和反应生成1mol水放出57.3 kJ的热量,反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) △ H=-57.3 kJ/mol,故答案为:H+(aq)+OH-(aq)=H2O(l) △ H=-57.3 kJ/mol。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用一定浓度NaOH溶液滴定醋酸溶液,滴定终点附近溶液pH和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点;溶液总体积变化忽略不计)下列说法正确的是
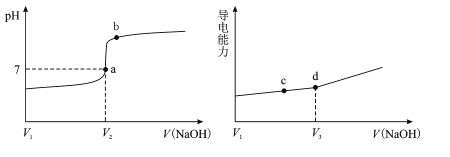
A.a→b过程中,水的电离程度不断增大
B.d点对应的溶液中:c(CH3COO-)+c(CH3COOH)=c(Na+)
C.c→d过程中,溶液导电性增强的主要原因是c(OH-)和c(Na+)增大
D.根据溶液pH和导电能力的变化可判断:V2>V3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2+3B2 =2AB3在2L的密闭容器中进行,5s后,A2的物质的量增加了0.3mol,则此反应的平均速率可表示为:
A.v (A2)=0.01 mol/(L·s)B.v (B2)=0.08 mol/(L·s)
C.v (AB3)=0.03 mol/(L·s )D.v (AB3)=0.06 mol/(L·s )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
(1)上述反应产物Cu2HgI4中,Cu元素显__价。
(2)以上反应中的氧化剂为__,当有1molCuI参与反应时,转移电子_mol。
(3)标明上述反应电子转移的方向和数目____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组为测定空气中CO2的含量,进行了如下实验:
①配制0.1000mol·L-1和0.01000mol·L-1的标准盐酸。
②用0.1000mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00mL,结果用去盐酸19.60mL。
③用测定的Ba(OH)2溶液吸收定量空气中的CO2。取Ba(OH)2溶液10.00mL,放入100mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10L标准状况下的空气,振荡,这时生成沉淀。
④过滤上述所得浊液。
⑤取滤液20.00mL,用0.01000mol·L-1的盐酸滴定,用去盐酸34.80mL。请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器?____;
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒 E.烧杯 F.胶头滴管 G.玻璃棒
(2)滴定操作中,左手____,右手____,眼睛____;
(3)Ba(OH)2溶液的物质的量浓度是____;
(4)过滤所得浊液的目的是____;
(5)此空气样品中含CO2的体积分数为____;
(6)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果____(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于临床研究,抗疟疾药物磷酸氯喹被证实在治疗新冠肺炎过程中具有疗效。4,7-二氯喹啉是合成磷酸氯喹的一种中间体,其结构简式如图所示。下列有关该物质的说法正确的是( )
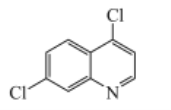
A.1mol 4,7-二氯喹啉最多可以消耗2molNaOH
B.分子中不可能所有原子在同一平面上
C.分子式为C8H5NCl2
D.苯环上的一氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够确定一溶液中一定含有![]() 的实验事实是( )
的实验事实是( )
A.取少量试样溶液,加入用盐酸酸化过的BaCl2溶液有白色沉淀生成
B.取少量试样溶液,加入用盐酸酸化过的Ba(NO3)2溶液,有白色沉淀生成
C.取少量试样溶液,加入足量盐酸无沉淀,加入BaCl2溶液,有白色沉淀生成
D.取少量试样溶液,加入BaCl2溶液有白色沉淀生成,再加稀盐酸,沉淀不溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种双电子介体电化学生物传感器,用于检测水体急性生物毒性,其工作原理如图。下列说法正确的是( )
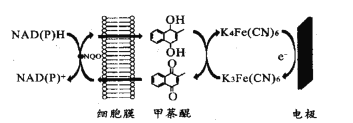
A.图中所示电极为阳极,其电极反应式为K4Fe(CN6)-e-=K3Fe(CN)6
B.甲荼醌在阴极发生氧化反应
C.工作时K+向图中所示电极移动
D.NAD(P)H转化为NAD(P)+的过程失去电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com