
����Ŀ��ij��ѧ����С��Ϊ�ⶨ������CO2�ĺ���������������ʵ�飺
������0.1000mol��L-1��0.01000mol��L-1�ı����ᡣ
����0.1000mol��L-1�ı�����ζ�δ֪Ũ�ȵ�Ba(OH)2��Һ10.00mL�������ȥ����19.60mL��
���òⶨ��Ba(OH)2��Һ���ն��������е�CO2��ȡBa(OH)2��Һ10.00mL������100mL����ƿ���ˮ���̶��ߣ�ȡ��ϡ�ͺ����Һ�����ܱ������ڣ���ͨ��10L��״���µĿ���������ʱ���ɳ�����
�ܹ�������������Һ��
��ȡ��Һ20.00mL����0.01000mol��L-1������ζ�����ȥ����34.80mL����ش��������⣺
��1�����Ʊ�����ʱ������������Щ����?____��
A.������ƽ B.����ƿ C.��ʽ�ζ��� D.��Ͳ E.�ձ� F.��ͷ�ι� G.������
��2���ζ������У�����____������____���۾�____��
��3��Ba(OH)2��Һ�����ʵ���Ũ����____��
��4������������Һ��Ŀ����____��
��5���˿�����Ʒ�к�CO2���������Ϊ____��
��6����ʵ���У�����һ�εζ�ʱʹ�õ���ʽ�ζ���δ����������ע��ڶ��ֱ����ᣬ�����еڶ��εζ���ʹ�ⶨ���____(�ƫ��ƫС������Ӱ�족)��
���𰸡�B��C��D��E��F��G ���ƻ��� ҡ����ƿ ע����ƿ����Һ��ɫ�ı仯 0.0980mol��L-1 �����BaCO3����ֹHCl��BaCO3��Ӧ 0.025% ƫ��
��������
��1����������һ�����ʵ���Ũ�ȵ���Һ�����Ʋ���ѡ��������
��2��������ȷ�ĵζ�ʵ�����������ɣ�
��3�����ݷ�Ӧ����ʽ���ζ����ݽ��м��㣻
��4�������̼�ᱵ����ֹ̼�ᱵ�����ᷴӦ��Ӱ��ζ������
��5�����������̼��Ӧ��ʣ���Ba(OH)2������Ba(OH)2�����ʵ��������������CO2�����ʵ��������������
��6���ڶ��εζ�ʱ����ʽ�ζ���û�д��������±�Һ�����Ũ��ƫ�����ĵ���������ƫС���������ʣ��������������ʵ���ƫС��
(1)����һ�����ʵ���Ũ�ȵ�����ʱ�������м��㡢ϡ�͡�ת�ơ�ϴ�ӡ����ݡ�ҡ�ȵȣ���Ҫ�����У�����ƿ����Ͳ(������ʽ�ζ���)���ձ�����ͷ�ιܼ�����������BCDEFG��
�ʴ�Ϊ��B��C��D��E��F��G��
(2)�ζ�����ʱ�����ֿ��ƻ���������ҡ����ƿ���۾�ע����ƿ����Һ��ɫ�仯��
�ʴ�Ϊ�����ƻ�����ҡ����ƿ��ע����ƿ����Һ��ɫ�ı仯��
(3)���ݷ�Ӧ����ʽ��Ba(OH)2+2HCl�TBaCl2+2H2O����c[Ba(OH)2]��10.00 mL=![]() ��0.1 mol/L��19.60 mL�����c[Ba(OH)2]= 0.0980mol��L-1��
��0.1 mol/L��19.60 mL�����c[Ba(OH)2]= 0.0980mol��L-1��
�ʴ�Ϊ��0.0980 mol��L-1��
(4)��һ����Ҫ������ζ��������̼��Ӧ��ʣ�������������Ϊ�˷�ֹBaCO3��HCl������Ӧ��Ӱ��ζ������Ӧ�÷����BaCO3��
�ʴ�Ϊ�������BaCO3����ֹHCl��BaCO3��Ӧ��
(5)�����ķ�Ӧ����ʽ��Ba(OH)2+CO2�TBaCO3��+H2O��20 mL��Һ��Ba(OH)2�����ʵ���Ϊ34.80��103��0.01��![]() mol=0.174��103 mol����ô100 mL��Һ����Ba(OH)2:100mL��Һ�к��е��������������ʵ���Ϊ��
mol=0.174��103 mol����ô100 mL��Һ����Ba(OH)2:100mL��Һ�к��е��������������ʵ���Ϊ��![]() =8.70��104 mol��ԭ�е��������������ʵ���Ϊ��0.098mol/L��10��103L=9.8��104mol��������ж�����̼���ĵ��������������ʵ���Ϊ��9.8��104mol8.70��104mol=1.1��104mol��n(CO2)=n[Ba(OH)2)]=1.1��104mol��
=8.70��104 mol��ԭ�е��������������ʵ���Ϊ��0.098mol/L��10��103L=9.8��104mol��������ж�����̼���ĵ��������������ʵ���Ϊ��9.8��104mol8.70��104mol=1.1��104mol��n(CO2)=n[Ba(OH)2)]=1.1��104mol��
������̼���������Ϊ��![]() ��100%=0.025%��
��100%=0.025%��
�ʴ�Ϊ��0.025%��
(6)������ʽ�ζ���û�д��������µڶ��εζ����ĵı�Һ�������ƫС��������������������ʵ���ƫС�����������̼��Ӧ�������������ʵ���ƫ������ƫ��
�ʴ�Ϊ��ƫ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ�����ӷ���ʽ��
��1��ʵ������ȡ�������õ�ҩƷ��п��ϡ���ᣬ��Ӧ�����ӷ���ʽΪ__��������ϡ�������ϡ���ᣬ��������п����Ӧ�����ӷ���ʽ��ʾΪ__��
��2��ʵ������̼��������ᷴӦ��ȡ������̼���壬��Ӧ�����ӷ���ʽ��__�����ó���ʯ��ˮ���������̼��������ӷ���ʽ��__��
��3��ͨ���ñ���С�մ���Һ��ȥ������̼�е��Ȼ��⣬��Ӧ�����ӷ���ʽΪ__������������������Һ��ԭ����__(�����ӷ���ʽ��ʾԭ����ͬ)��Ҳ������̼������Һ��ԭ����__��
��4�������渽������(�ɷ���Fe2O3)����������ϡ�����У�һ��ʼ��Һ����ɫ��ɻ�ɫ����ʱ��Ӧ�����ӷ���ʽ��__���ܿ���Һ���ɻ�ɫ���dz��ɫ�������ӷ�Ӧ����ʽ��ʾ�����ɫ�仯��__������ֿɹ۲쵽����������������ӷ���ʽ��__��
��5������θҺ����θ��(0.2%��0.4%������)����ɱ�����������������ã���θ��������ܹ������٣������������һ����Χ�ڣ���θ�����ʱ��ҽ��ͨ������С�մ�Ƭ������θ��ƽ�����������ơ�
����С�մ�Ƭ(NaHCO3)����θ���������ӷ���ʽΪ__�����������ͬʱ����θ����ʱ��÷���θ��ƽ[��Ҫ�ɷ���Al(OH)3]����Ӧ�����ӷ���ʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С�����Fe(OH)3������Ʊ�ʵ�鲢���������ʡ�
(1)��������FeCl3��Һ�ֱ�������������У����γɽ������________(����ĸ)��
A.��ˮ B.��ˮ C.NaOHŨ��Һ D.NaClŨ��Һ
(2)���мס��ҡ�������ͬѧ����Fe(OH)3������Ʊ���
�ټ�ͬѧ�IJ�����ȡһС�ձ�������25 mL����ˮ���������ڣ����ˮ����μ���1��2 mL FeCl3������Һ��������������Һ�ʺ��ɫ��ֹͣ���ȡ������۸ò����Ƿ���ȷ______��
����ֱ�Ӽ��ȱ���FeCl3��Һ���������Ƿ���ȷ______��
�۱����ˮ�еμӱ���FeCl3��Һ��Ϊ��ʹ��Ӧ���г�֣����10���ӣ��������Ƿ���ȷ________��
(3)д���Ʊ�Fe(OH)3����Ļ�ѧ����ʽ�� ____________________��֤����Fe(OH)3�������ɵ�ʵ�������_____________________���ò������ý����������________��
(4)Fe(OH)3�����ȶ����ڵ���Ҫԭ����____________________(����ĸ����ͬ)��
A.��������ֱ��С��1nm B.�������Ӵ������
C.���������������˶� D.��������������ֽ
(5)Fe(OH)3����������FeCl3��Һ��ʵ�������________��
A.Fe(OH)3�������ӵ�ֱ����1��100 nm֮��
B.Fe(OH)3������ж����ЧӦ
C.Fe(OH)3�����Ǿ�һ�ķ�ɢϵ
D.Fe(OH)3����ķ�ɢ��������ֽ
(6)��ȡ�����ƵõĽ�������Թ��У������������Һ��������_____________�����������Ϊ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ��������һ����Դ��Ҳ����������Σ����
I��������һ����Ҫ�Ļ���ԭ�ϡ�
��1��NH3��CO2��120��C�����������·�Ӧ�������أ�CO2��g��+2NH3��g��![]() ��NH2��2CO��s��+H2O��g������H= -x KJ/mol (x>0)������������������
��NH2��2CO��s��+H2O��g������H= -x KJ/mol (x>0)������������������
���� | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
1mol�����еĻ�ѧ������ʱ��Ҫ���յ�����/KJ | a | b | z | d |
�����z����x a b d��ʾ���Ĵ�СΪ________��
��2��120��ʱ����2L�ܱշ�Ӧ�����г���3mol CO2��NH3�Ļ�����壬���������NH3����������淴Ӧʱ��仯��ϵ��ͼ��ʾ���÷�Ӧ����ƽ��ʱCO2��ƽ����Ӧ����Ϊ_____, ���¶�ʱ��ƽ�ⳣ��Ϊ_____��

������ʹ����Ӧ�Ļ�ѧ��Ӧ���ʼӿ�Ĵ�ʩ��___________.
�� ��ʱ��������� �� �����¶� �� ���ܱն����������ٳ���CO2 �� �����¶�
�������������Ⱦ������Ŀǰ�����᳧β�������ɲ���NH3����NO�ڴ������ڵ����������ã�����Ⱦ��ת��Ϊ����Ⱦ�����ʡ�ij�о�С������֤NO�ܱ�������ԭ��������ת���ʣ���֪Ũ�����ڳ����²�����NO���壩��

(l��д��װ�â��з�Ӧ�Ļ�ѧ����ʽ_________��
(2��װ�âٺ�װ�â�����ͼ������A������Ϊ_____������ʢ�ŵ�ҩƷ����Ϊ_______��

װ�â��У������Թ��м���2-3 ��ʯ��ʯ��ע������ϡ���ᣬ��Ӧһ��ʱ��������ϴ���ϸͭ˿�Ľ������к�����Ӧ������ʯ��ʯ��������________��
��3��װ�â��У�С�β����ܵ�������______��װ�âߵ������dz�ȥNO, NO��FeSO4��Һ��Ӧ�γ���ɫ[Fe(NO)]SO4��Һ��ͬʱװ�â��������鰱���Ƿ������������δ�������ɹ۲쵽��ʵ��������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50 mL 0.50 mol��L��1������50 mL 0.55 mol��L��1 NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺
(1)��ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ���������________���ձ�����������ĭ���ϵ�������________

(2)���ձ����粻��Ӳֽ�壬��õ��к�����ֵ_______ (����ƫ��������ƫС��������Ӱ����)��
(3)ʵ���и���60 mL 0.50 mol��L��1������50 mL 0.55 mol��L��1 NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������__________(��������������������)�������к���__________(��������������������)��
(4)����ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ��_____(����ƫ������ƫС��������Ӱ����)��
(5)д���÷�Ӧ���Ȼ�ѧ����ʽ��____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С��Ϊ��֤������ԭ��SO2��I����Fe2���Ļ�ԭ��ǿ����˳��ΪSO2��I����Fe2��������ͼ��ʾװ�ý���ʵ��(���Ⱥͼг�װ�����ԣ��������Ѽ���)��
��֪��MnO2��4HCl(Ũ)![]() MnCl2��Cl2����2H2O��Na2SO3��H2SO4=Na2SO4��H2O��SO2����
MnCl2��Cl2����2H2O��Na2SO3��H2SO4=Na2SO4��H2O��SO2����
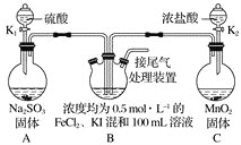

��1������ʵ����Ҫ���ȵ�װ����_____��
��2��D���ձ�ʢ�ŵ���____��
��3��ʵ�鿪ʼʱ���ر�K1����K2��ͨ������������д��B�з�����Ӧ�����ӷ���ʽ___��
��Ϊ��֤I���Ļ�ԭ�Ա�Fe2��ǿ��ȡ(3)��B�е�������Һ���Թ��У�Ӧ�����Թ��е���___��Һ��������____��
���ڣ�3����Ϊ�˱Ƚ�SO2��I���Ļ�ԭ��ǿ�����������IJ�����___��
A���ر�K2��K1
B���ر�K1��K2
C��ͬʱ��K1��K2
��4������K2��ͨ��Cl2ǡ�ý�Fe2����I��ȫ���������ٴ�K1ͨ��SO2����Fe3��ȫ��ת��ΪFe2��ʱ����ʱͨ���SO2�����(��״����)Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʻ���COS������Ϊһ����ʳѬ�������ܷ�ֹijЩ���桢�߳�������Σ�����ں����ܱ������У���CO��H2S��ϼ��Ȳ��ﵽ����ƽ�⣺
CO��g��+H2S��g��![]() COS��g��+H2��g�� K=0.1
COS��g��+H2��g�� K=0.1
��ӦǰCO���ʵ���Ϊ10mol��ƽ���CO���ʵ���Ϊ8mol������˵����ȷ����
A. �����¶ȣ�H2SŨ�����ӣ������÷�Ӧ�����ȷ�Ӧ
B. ͨ��CO������Ӧ����������
C. ��ӦǰH2S���ʵ���Ϊ7mol
D. CO��ƽ��ת����Ϊ80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ɸ�������ɺ����ʽ��з��ࡣ
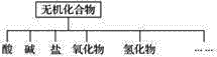
��1����ͼ��ʾ�����ʷ����������____________��
��2�����ơ��ء��⡢����̼�����������ֻ�����Ԫ����ɺ��ʵ����ʣ��ֱ������±��еĺ����ϣ�
������� | �� | �� | �� | ������ | �⻯�� |
��ѧʽ | ��HCl ��____ | ��____ ��Ba��OH��2 | ��Na2CO3 ��____ | ��CO2 ��Na2O | ��NH3 ��H2O2 |
��3��д����ת��Ϊ�ݵĻ�ѧ����ʽ__________��
��4��д��ʵ�����ɢ��Ʊ������Ļ�ѧ����ʽ______��
��5��ʵ�����Ʊ��߳���________��________��Ӧ�����������ķ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��������Ժ����Ҫ�Ļ���ԭ�ϣ���;�㷺���ش��������⣺
��֪��I.2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ��H1=-206.6kJmo1-1
(g) ��H1=-206.6kJmo1-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O��1�� ��H2
III.2![]() (g)+5O2(g)=4CO2(g)+4H2O��1�� ��H3
(g)+5O2(g)=4CO2(g)+4H2O��1�� ��H3
��1����ӦIII����S(����>����<������=��)___0��
��2����ֵ�DZ�ʾ��λ������ȼ����ȫȼ��ʱ���ų�����������ȼ��������һ����Ҫָ�ꡣ��֪��ϩ����ֵΪ50.4kJg-1�����H3=___kJmol-1
��3��ʵ����2CH2=CH2(g)+O2(g)![]() 2
2![]() (g)��v��=k��c2(
(g)�У�v��=k��c2(![]() ����v��=k��c2(CH2=CH2)c(O2)(k����k��Ϊ���ʳ�����ֻ���¶��йأ���
����v��=k��c2(CH2=CH2)c(O2)(k����k��Ϊ���ʳ�����ֻ���¶��йأ���
�ٷ�Ӧ�ﵽƽ��������¶ȣ�����˵����ȷ������________��
A.k����k����������k������ı�������
B.k����k���ȼ�С����k����С�ı�������
C.k������k����С��ƽ�������ƶ�
D.k����k������С����k����С�ı�������
������1L���ܱ������г���1molCH2=CH2(g)��1molO2(g)����һ���¶���ֻ������ӦI������10min��Ӧ�ﵽƽ�⣬��ϵ��ѹǿ��Ϊԭ����0.875������0~10min��v(O2)=___��![]() =___��
=___��
��4���ִ��Ʊ���ϩ�������������ѽⷨ��
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) ��H2=-110kJmol-1����Ӧ�л�����CH4��CO��CO2�ȸ��������Ӧ��Ϊ���ȷ�Ӧ����ͼ1Ϊ�¶ȶ����������ѽⷴӦ���ܵ�Ӱ�졣
O2(g)=C2H4(g)+H2O(g) ��H2=-110kJmol-1����Ӧ�л�����CH4��CO��CO2�ȸ��������Ӧ��Ϊ���ȷ�Ӧ����ͼ1Ϊ�¶ȶ����������ѽⷴӦ���ܵ�Ӱ�졣
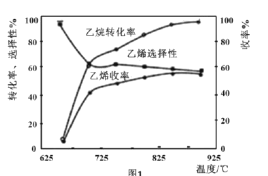
�������ת�������¶ȵ����߶����ߵ�ԭ����___����Ӧ������¶�Ϊ___������ţ���
A.650�� B.700�� C.850�� D.900��
����ϩѡ����=![]() ����ϩ����=����ת���ʡ���ϩѡ���ԣ�
����ϩ����=����ת���ʡ���ϩѡ���ԣ�
�ڹ�ҵ�ϣ�������ϵ��ѹ�㶨Ϊl00kPa�������½��и÷�Ӧ��ͨ��������������Ļ�������в���������壨����������������Ϊ70%)��������������Ŀ����___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com