
【题目】
镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2-
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数只能为4
D.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化
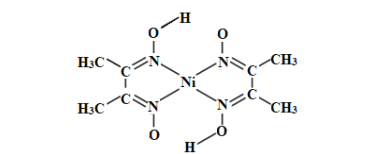
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“”分别表示出配位键和氢键。_____
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
![]()
NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。

①LaNix合金中x的值为_____;
②晶胞中和“![]() ”同类的八面体空隙有___个,和“
”同类的八面体空隙有___个,和“![]() ”同类的四面体空隙有___个。
”同类的四面体空隙有___个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______g/cm-3(保留2位有效数字,NA=6.0×1023,![]() =1.7)
=1.7)
【答案】3d84s2 5 A 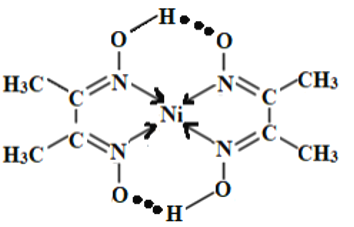 6 离子所带电荷数越高,离子半径越小,则晶格能越大,熔点越高 5 3 6 0.18
6 离子所带电荷数越高,离子半径越小,则晶格能越大,熔点越高 5 3 6 0.18
【解析】
(1)依据Ni的最外层电子排布式作答;
(2)A. CO与N2互为等电子体,互为等电子体的两种物质结构相似;
B. 依据价层电子对互斥理论和杂化轨道理论作答;
C. 找出[Ni(CN)4]2-和[Ni(NH3)6]2+两种配合物的配体个数;
D. 依据杂化轨道理论分析其杂化类型;
(3)依据配位键与氢键的存在原子种类分析;
(4)NiO的晶体结构类型与氯化钠相同;从离子晶体的晶格能角度分析熔点高低;
(5)①利用均摊法求出晶胞中La与Ni的原子个数比,进而得出化学式;
②根据空间构型分析作答;
③结合几何关系,找出六方晶胞的体积,再依据密度公式作答。
(1)Ni为28号元素,价电子排布式为3d84s2,排布时能量最高的电子所占的能级为3d,3d轨道有5个伸展方向,故答案为:3d84s2;5;
(2)A. CO、CN-与N2互为等电子体,N2分子内含1个σ键和2个π键,A项正确;
B. NH3中N原子为sp3杂化方式,VSEPR模型为四面体形,空间构型为三角锥形,B项错误;
C. [Ni(CN)4]2-和[Ni(NH3)6]2+中的Ni的化合价为+2价,其配位数分别是4和6,C项错误;
D. [Ni(CN)4]2-为正四面体,采用sp3杂化,而[Ni(NH3)6]2+是正方形,不是sp3杂化方式,D项错误;
故答案选A;
(3)中心原子提供空轨道,配体提供孤电子对形成配位键;氢键存在于已经与N、O和F等电负性很强的原子形成的共价键的H与另外的N、O和F等电负性很大的原子之间,则可以为: ;
;
(4)氯化钠中钠离子和氯离子的配位数分别是6,NiO的晶体结构类型与氯化钠相同,NiO晶胞中Ni和O的配位数分别6,影响离子晶体熔点的因素有离子半径和电荷,所带电荷数越高,离子半径越小,则晶格能越大,熔点越高;
(5)①该晶体的晶胞不是六棱柱,而是实线部分表示的平行六面体,各原子在晶胞中的位置可参照图a和b,如果将平行六面体抽取出来,晶胞如下图所示,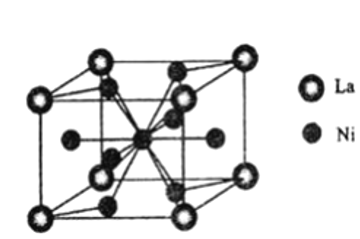 ,La在顶点,Ni在面心有4个(其中顶层和底层各2个,均摊后各1个,前后左右4个面各1个,均摊后共2个)和体心(1个),所以晶体化学式为LaNi5,x=5,
,La在顶点,Ni在面心有4个(其中顶层和底层各2个,均摊后各1个,前后左右4个面各1个,均摊后共2个)和体心(1个),所以晶体化学式为LaNi5,x=5,
②其正八面体空隙和四面体型空隙的位置如下图所示:
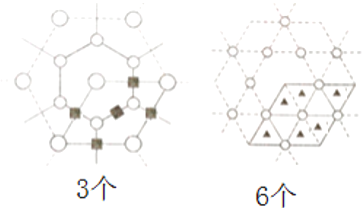 ,(若以空心球表示原子,实心球表示空隙的中心,则正八面体结构为
,(若以空心球表示原子,实心球表示空隙的中心,则正八面体结构为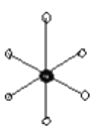 ,四面体结构为:
,四面体结构为: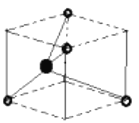 ;
;
③六方晶胞体积V=a2csinθ=(500×10-10)2×400×10-10×sin60°=8.5×10-23 cm3,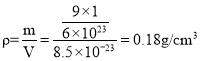 。
。


科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,其中A是四元化合物,C是能使湿润红色石蕊试纸变蓝的气体,D是淡黄色固体化合物,E是单质。各物质之间存在如图转化关系(部分产物未标出)。下列说法不正确的是
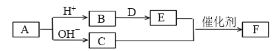
A.简单离子半径大小关系:c>d>e
B.简单阴离子的还原性:a>c>d
C.氢化物的沸点:c>d
D.C和E反应生成F是工业制硝酸的重要反应之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种无色液态物质:己烯、己烷、苯、甲苯和苯酚符合下列各题要求的分别是:
(1)不与浓溴水反应但能与KMnO4酸性溶液反应的是_______。
(2)在空气中能被氧化成粉红色,该物质是_______。写出该物质与浓溴水反应的化学方程式________。
(3)不能与溴水和KMnO4酸性溶液反应,但在铁屑作用下能与液溴反应的是____,反应的化学方程式为________,此反应属于______反应。
(4)既能与溴水又能与KMnO4酸性溶液反应的烃是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按要求书写下列化学方程式和名称:
(1)1,3-丁二烯与等物质的量的单质溴在60℃时发生1,4-加成_________
(2)甲苯制备TNT_______,用系统命名给TNT命名________
(3)写出2-丙醇的消去反应化学方程式_________
Ⅱ.(1)某烃A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有一个碳碳双键,与氢气加成反应可得到结构简式为(CH3)2CHCH(CH3)2的烷烃,则此烯烃可能的结构简式是:_____(任写一种)。
(2)核磁共振谱表明A分子中只有一种类型的氢。
①用系统命名法给A命名:_________。
②A中的碳原子是否都处于同一平面?________(填“是”或者“不是”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:
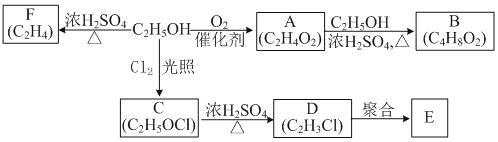
回答下列问题:
(1)A的结构简式为_________。
(2)B的化学名称是_____。
(3)由A生成B的化学反应类型为_______。
(4)E是一种常见的塑料,其化学名称是_______。
(5)由乙醇生成F的化学方程式为____。
(6)C5H12O与乙醇互为同系物,其能被催化氧化的同分异构体有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是( )
A.气态氢化物的稳定性:HBr>HIB.在短周期中,金属性最强的元素是钠,非金属性最强的元素是氟
C.向Na2SO3溶液中加盐酸,有气泡产生D.镁条、铝片分别与同浓度盐酸反应,Mg的反应更容易
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A.某溶液中加入KSCN溶液呈红色,说明原溶液不含有Fe2+离子
B.某溶液中通入氯气,然后再加入KSCN溶液呈红色,说明原溶液中一定有Fe2+离子
C.某溶液中加入氢氧化钠溶液生成红褐色沉淀,说明原溶液中一定有Fe3+离子
D.某溶液中加入稀硫酸溶液产生无色气体,说明原溶液中一定有![]() 离子
离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化氮(NCl3)是一种消毒剂,可利用氯气与氯化铵溶液反应来制备。已知:三氯化氮的相关性质如下:
物理性质 | 化学性质 |
黄色油状液体,熔点为-40℃,沸点为 71℃,不溶于冷水、易溶于有机溶剂,密度为 1.65 gcm-3 | 95℃时爆炸,热水中发生水解 |
某小组同学选择下列装置(或仪器)设计实验制备三氯化氮并探究其性质:
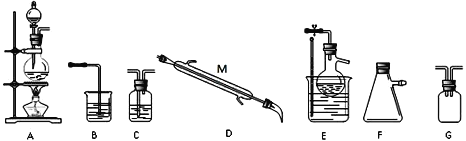
(1)NCl3的电子式为__________________;仪器 M 的名称是______________;
(2)如果气流的方向从左至右,装置连接顺序为A、G、_____________、B。(注明:F仪器使用单孔橡胶塞)
(3)C中试剂是_________________;B装置的作用是________________;
(4)写出E装置中发生反应的化学方程式_______________________________________
(5)当E装置的烧瓶中出现较多油状液体时停止反应。控制水浴加热温度为__________;
(6)已知三氯化氮不具有漂白性,三氯化氮与热水反应的化学方程式为NCl3+4H2O=NH3H2O+3HClO,请设计实验证明该水解反应的产物______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com