
【题目】下列离子检验的方法正确的是
A.某溶液中加入KSCN溶液呈红色,说明原溶液不含有Fe2+离子
B.某溶液中通入氯气,然后再加入KSCN溶液呈红色,说明原溶液中一定有Fe2+离子
C.某溶液中加入氢氧化钠溶液生成红褐色沉淀,说明原溶液中一定有Fe3+离子
D.某溶液中加入稀硫酸溶液产生无色气体,说明原溶液中一定有![]() 离子
离子
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法命名:
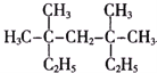 __________________.
__________________.
(2)按要求写出有机物的结构简式:支链只有一个乙基且相对分子质量最小的烷烃________.
(3)羟基的电子式为________.
(4)![]() 与Br2发生1,4加成反应的化学方程式为________.
与Br2发生1,4加成反应的化学方程式为________.
(5)下列说法错误的为________(填选项字母)
a.实验室制取乙烯时,将温度计的水银球插入液面以下
b.将氯乙烷溶于滴有HNO3的AgNO3溶液中,可检验氯乙烷分子中含有的氯原子
c.溴乙烷和NaOH的醇溶液混合物加热,将产生的气体直接通入酸性KMnO4溶液来检验反应是否生成了乙烯
d.将铜丝绕成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,无水乙醇可被氧化为乙醛
(6)A和B的分子式均为C2H4Br2,A的核磁共振氢谱只有一个吸收峰,则A的结构简式为___,请预测B的核磁共振氢谱有___个吸收峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z、W 原子序数依次增大,Y 与 W 同族。X、Y、Z 三种原子最外层电子数的关系 为 X+Z=Y。电解 Z 与 W 形成的化合物的水溶液,产生 W 元素的气体单质,此气体同冷烧碱溶液作 用,可得到化合物 ZWX 的溶液。下列说法正确的是
A.W 的氢化物稳定性强于 Y 的氢化物
B.Z与其他三种元素分别形成的化合物中只含有离子键
C.Z 与 Y 形成的化合物的水溶液呈碱性
D.对应的简单离子半径大小为 W >Z > X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2-
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数只能为4
D.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“”分别表示出配位键和氢键。_____
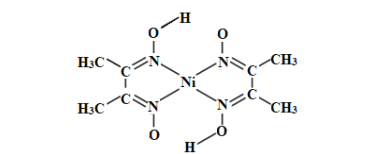
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
![]()
NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。

①LaNix合金中x的值为_____;
②晶胞中和“![]() ”同类的八面体空隙有___个,和“
”同类的八面体空隙有___个,和“![]() ”同类的四面体空隙有___个。
”同类的四面体空隙有___个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______g/cm-3(保留2位有效数字,NA=6.0×1023,![]() =1.7)
=1.7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:H2O2具有立体结构,两个氢原子像在半展开一本书的两页上,两页纸面的夹角为94°,氧原子在书的夹缝上, O—H键与O—O键之间的夹角为97°,如图所示,下列说法错误的是 ( )
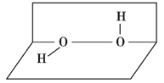
A. H2O2分子中既有极性键又有非极性键
B. H2O2分子为含有非极性键的极性分子
C. H2O2分子为非极性分子
D. H2O2分子为既含极性键又含非极性键的极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,利用NH3催化氧化并释放出电能(氧化产物为无污染性气体),其工作原理示意图如下。下列说法正确的是
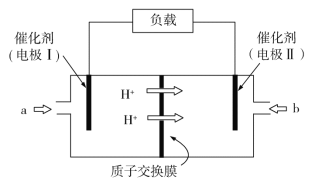
A.电极Ⅰ为正极,电极上发生的是氧化反应
B.电极Ⅰ的电极反应式为2NH36e![]() N2+6H+
N2+6H+
C.电子通过外电路由电极Ⅱ流向电极Ⅰ
D.当外接电路中转移4 mol e时,消耗的O2为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质的焰色反应都呈黄色,A、B分别与水反应都有气体放出同时都生成C溶液,A与水反应生成的气体具有还原性,B与水反应生成的气体具有氧化性,C与适量的F气体反应生成D,D溶液与F反应生成E,E加热生成D和气体F。
根据以上叙述回答下列问题:
(1)写出下列物质的化学式:A_____B____C____D____E____F_____
(2)按要求完成方程式
①A与水反应的离子方程式_____________________
②E溶液和C溶液反应的离子方程式_____________
③B与F反应的化学方程式____________________
④E加热生成D和F的化学方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图所示。

已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60~70℃,原因是____________________。
(2)写出“转化”过程中的离子方程式____________________。
(3)“过滤Ⅱ”所得滤液经__________、__________、过滤等操作获得(NH4)2SO4晶体,可用作化学肥料。“过滤Ⅱ”所得滤渣主要成分为CuCl,用乙醇洗涤的优点是________________。
(4)氯化铵用量[![]() ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是__________。
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是__________。

(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:__________。(实验中可选试剂:0.1 mol·L1盐酸、10 mol·L1盐酸、蒸馏水、无水乙醇)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心。回答下列问题:
(1)乙烷可通过热裂解和氧化裂解制取乙烯。已知下列键能数据:
化学键 | C—C | C=C | C—H | H—H |
键能/ kJ·mol -1 | 347. 7 | 615 | 413. 4 | 436. 0 |
①乙烷直接裂解制乙烯的热化学方程式为_____________________________。
②氧化裂解制乙烯的热化学方程式为C2H6(g) + ![]() O2(g) = C2H4(g) + H2O(g) △H = - 105 kJ·mol-1 . 结合①分析,氧化裂解相对热裂解生产乙烯的优点是:_____________________________________(列举1点)。
O2(g) = C2H4(g) + H2O(g) △H = - 105 kJ·mol-1 . 结合①分析,氧化裂解相对热裂解生产乙烯的优点是:_____________________________________(列举1点)。
(2)利用生物乙醇在某种分子筛催化下可脱水制取乙烯,相应反应如下:
I. C2H5OH(g) ![]() C2H4(g) + H2O(g)
C2H4(g) + H2O(g)
Ⅱ. 2C2H5OH(g) ![]() (C2H5)2O(g) + H2O(g)
(C2H5)2O(g) + H2O(g)
平衡常数[Kp是用平衡分压代替平衡浓度(平衡分压=总压×物质的量分数)]及产品选择性如下图所示:
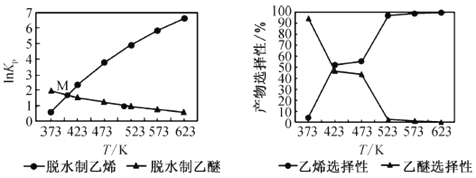
①反应 C2H5OH(g) ![]() C2H4(g) + H2O(g) 的△H______(填“>”或“<”)0。
C2H4(g) + H2O(g) 的△H______(填“>”或“<”)0。
②关于上图中交点M,下列说法正确的是________(填字母)。
a. 一段时间内,反应I、Ⅱ的速率相等
b. 某温度下,反应I、Ⅱ的平衡常数相等
c. 一段时间内,反应I、Ⅱ中乙醇的转化率相等
(3)利用煤制合成气,再由合成气间接制乙烯包含的反应有:
I. CO(g) +2H2(g) ![]() CH3OH(g) △H=a kJ·mol-1
CH3OH(g) △H=a kJ·mol-1
Ⅱ. 2CH3QH(g) ![]() C2H4(g) + 2H2O(g) △H =b kJ·mol-1
C2H4(g) + 2H2O(g) △H =b kJ·mol-1
①反应 2CO(g) + 4H2(g) ![]() C2H4(g) + 2H2O(g) △H = _________kJ·mol-1 (用 a、b表示)。
C2H4(g) + 2H2O(g) △H = _________kJ·mol-1 (用 a、b表示)。
②在容积为1 L的密闭容器中,投入2 mol CO和4 mol H2,10 min后,测得c(CO) = 1. 2 mol·L-1·min-1,则10 min内v(H2)=_____________ mol·L-1·min-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com