
【题目】实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图所示。

已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60~70℃,原因是____________________。
(2)写出“转化”过程中的离子方程式____________________。
(3)“过滤Ⅱ”所得滤液经__________、__________、过滤等操作获得(NH4)2SO4晶体,可用作化学肥料。“过滤Ⅱ”所得滤渣主要成分为CuCl,用乙醇洗涤的优点是________________。
(4)氯化铵用量[![]() ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是__________。
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是__________。

(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:__________。(实验中可选试剂:0.1 mol·L1盐酸、10 mol·L1盐酸、蒸馏水、无水乙醇)
【答案】温度低溶解速度慢、温度过高铵盐分解 2Cu2++ SO32-+2Cl+H2O![]() 2CuCl↓+ SO42-+2H+ 蒸发浓缩 降温结晶 CuCl在乙醇中溶解度小且乙醇挥发快,避免CuCl被空气中O2氧化 生成的氯化亚铜又溶解于氯化铵溶液中 向产品中加入10 mol·L1盐酸,不断搅拌,至固体不再溶解,过滤,向滤液中加蒸馏水至大量固体析出,过滤,再用无水乙醇洗涤2~3次,干燥
2CuCl↓+ SO42-+2H+ 蒸发浓缩 降温结晶 CuCl在乙醇中溶解度小且乙醇挥发快,避免CuCl被空气中O2氧化 生成的氯化亚铜又溶解于氯化铵溶液中 向产品中加入10 mol·L1盐酸,不断搅拌,至固体不再溶解,过滤,向滤液中加蒸馏水至大量固体析出,过滤,再用无水乙醇洗涤2~3次,干燥
【解析】
实验流程中,海绵铜(主要成分为Cu和CuO)中加入硝酸铵和硫酸,酸性条件下硝酸根离子具有氧化性,可氧化海绵铜生成Cu2+,滤液中含有Cu2+、NH4+、H+、SO42-、NO3-,过滤后在滤液中加入亚硫酸铵,发生氧化还原反应生成CuCl,发生反应:2Cu2++SO32-+2Cl+H2O![]() 2CuCl↓+ SO42-+2H+,得到产品CuCl,据此分析。
2CuCl↓+ SO42-+2H+,得到产品CuCl,据此分析。
(1)物质“溶解氧化”时,既要考虑反应速率,还要考虑是否有副反应发生,温度低溶解速度慢、温度过高铵盐分解。答案为:温度低溶解速度慢、温度过高铵盐分解;
(2)“转化”中氧化产物为硫酸铵,滤液主要是硫酸铵。可知亚硫酸铵被溶液中的CuSO4氧化成硫酸铵,Cu2+被还原生成CuCl。答案为:2Cu2++SO32-+2Cl+H2O![]() 2CuCl↓+ SO42-+2H+;
2CuCl↓+ SO42-+2H+;
(3)“过滤Ⅱ”所得滤液为硫酸铵溶液,获取晶体需通过蒸发浓缩、降温结晶、过滤等操作。CuCl在乙醇中溶解度小且乙醇沸点低,易挥发,避免因水洗干燥时间长而导致CuCl被氧气氧化。答案为:蒸发浓缩、降温结晶;CuCl在乙醇中溶解度小且乙醇挥发快,避免CuCl被空气中O2氧化;
(4)根据题中已知条件,CuCl可溶于氯离子浓度较大的溶液中。当氯化铵用量增加到一定程度后,氯化亚铜的沉淀率减小,原因是生成的氯化亚铜又溶解于氯化铵溶液中。答案为:生成的氯化亚铜又溶解于氯化铵溶液中;
(5)由题目已知资料可知,CuCl难溶于水和乙醇,可溶于氯离子浓度较大的溶液中。若CuCl产品中混有少量CaSO4,向产品中加入10 mol·L1盐酸,不断搅拌,至固体不再溶解,过滤,向滤液中加蒸馏水至大量固体析出,过滤,再用无水乙醇洗涤2~3次,干燥即可得到纯净氯化亚铜。答案为:向产品中加入10 mol·L1盐酸,不断搅拌,至固体不再溶解,过滤,向滤液中加蒸馏水至大量固体析出,过滤,再用无水乙醇洗涤2~3次,干燥。


科目:高中化学 来源: 题型:
【题目】有5种无色液态物质:己烯、己烷、苯、甲苯和苯酚符合下列各题要求的分别是:
(1)不与浓溴水反应但能与KMnO4酸性溶液反应的是_______。
(2)在空气中能被氧化成粉红色,该物质是_______。写出该物质与浓溴水反应的化学方程式________。
(3)不能与溴水和KMnO4酸性溶液反应,但在铁屑作用下能与液溴反应的是____,反应的化学方程式为________,此反应属于______反应。
(4)既能与溴水又能与KMnO4酸性溶液反应的烃是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A.某溶液中加入KSCN溶液呈红色,说明原溶液不含有Fe2+离子
B.某溶液中通入氯气,然后再加入KSCN溶液呈红色,说明原溶液中一定有Fe2+离子
C.某溶液中加入氢氧化钠溶液生成红褐色沉淀,说明原溶液中一定有Fe3+离子
D.某溶液中加入稀硫酸溶液产生无色气体,说明原溶液中一定有![]() 离子
离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3在水中易分解。一定条件下,起始浓度均为0.0216mol/L的O3溶液,在不同的pH、温度下,发生分解反应,测得O3浓度减少一半所需的时间(t)如下表所示:
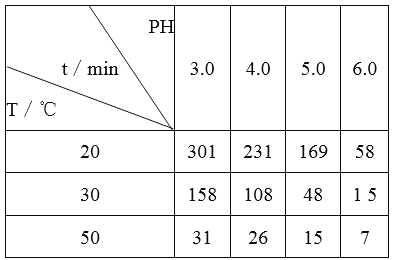
下列判断不正确的是
A. 实验表明,升高温度能加快O3的分解速率
B. pH增大能加速O3分解,表明OH-可以对O3的分解起催化作用
C. 在30℃、pH=4.0时,O3的分解速率为1.00×10-4mol/(L·min)
D. 据表中的规律可推知,O3在下列条件下的分解速率v(40℃、pH=3.0)>v(30℃、pH=7.0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对如图所示有机物分子的叙述错误的是( )

A. 碱性条件下能发生水解,1 mol该有机物完全反应消耗8 mol NaOH
B. 常温下,能与Na2CO3溶液反应放出CO2
C. 与稀硫酸共热,能生成两种有机物
D. 该有机物遇FeCl3溶液显色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关甲、乙的说法不正确的是
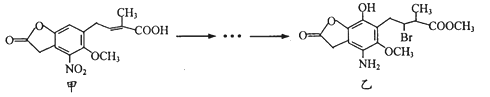
A. 甲的分子式为C14H11NO7
B. 甲和乙所含官能团均为5种
C. 可用NaHCO3溶液鉴别化合物甲和乙
D. 甲能与酸性高锰酸钾溶液反应,乙能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化氮(NCl3)是一种消毒剂,可利用氯气与氯化铵溶液反应来制备。已知:三氯化氮的相关性质如下:
物理性质 | 化学性质 |
黄色油状液体,熔点为-40℃,沸点为 71℃,不溶于冷水、易溶于有机溶剂,密度为 1.65 gcm-3 | 95℃时爆炸,热水中发生水解 |
某小组同学选择下列装置(或仪器)设计实验制备三氯化氮并探究其性质:
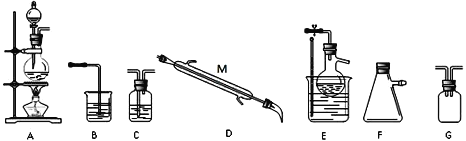
(1)NCl3的电子式为__________________;仪器 M 的名称是______________;
(2)如果气流的方向从左至右,装置连接顺序为A、G、_____________、B。(注明:F仪器使用单孔橡胶塞)
(3)C中试剂是_________________;B装置的作用是________________;
(4)写出E装置中发生反应的化学方程式_______________________________________
(5)当E装置的烧瓶中出现较多油状液体时停止反应。控制水浴加热温度为__________;
(6)已知三氯化氮不具有漂白性,三氯化氮与热水反应的化学方程式为NCl3+4H2O=NH3H2O+3HClO,请设计实验证明该水解反应的产物______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.已知:Na2SO3(aq)+S(s)![]() Na2S2O3(aq),实验可知该反应较慢。工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如图所示装置(略去部分夹持仪器)模拟生产过程。
Na2S2O3(aq),实验可知该反应较慢。工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如图所示装置(略去部分夹持仪器)模拟生产过程。
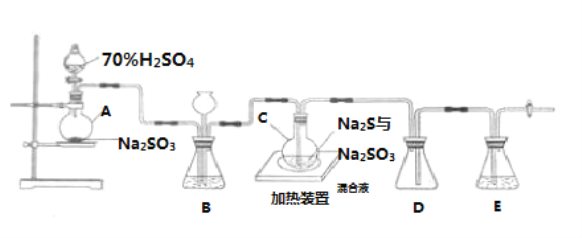
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若_______,则整个装置气密性良好。装置D的作用是______________________________________ 。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择___________。
a.蒸馏水 b .饱和Na2SO3溶液
c.饱和NaHSO3溶液 d . 饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是____________。烧瓶C中反应达到终点的现象是____________________。待C中反应完成后应立即关闭分液漏斗的旋塞,原因是_______________________。
(3)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O35H2O,其中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:_______________________________________________。供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com