
【题目】汽车的启动电源常用铅蓄电池,电池反应如下: PbO2 + Pb + 2H2SO4 ![]() 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
A. PbO2放电时是电池的负极,充电时是电池的阳极
B. 负极的电极反应式为:Pb + SO42—– 2e–=PbSO4
C. 放电时,PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:CH3OH(g)+CO(g) ![]() CH3COOH(g)ΔH<0。下列说法正确的是
CH3COOH(g)ΔH<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 600 | 1.0 | 1.0 | 0 | 0.80 |
II | 600 | 0.40 | 0.40 | 0.80 | |
III | 575 | 0 | 0 | 1.0 | |
A. 达平衡时,容器II中![]() 比容器I中的大
比容器I中的大
B. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
C. 达平衡时,容器I与容器II中的总压强之比为5:6
D. 达平衡时,容器Ⅲ中c(CH3COOH)小于0.80mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A. v(A2)=0.8 mol·L-1·s-1 B. v(A2)=30 mol·L-1·min-1
C. v(AB3)=1.0 mol·L-1·s-1 D. v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500oC下,在2L体积固定的密闭容器中发生反应:2A(g)![]() 2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
(1)计算500oC时该反应的化学平衡常数?
(2)平衡时A的转化率是多少?
(3)设温度不变,反应前容器内压强为p0,则反应达平衡时,容器内压强是多少?(用p0表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应:N2(g) + O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
(1)已知H2或CO可以催化还原NO以达到消除污染的目的。N2(g) + O2(g) = 2NO(g) △H= +180.5 kJ·mol-1,2H2(g) + O2(g) = 2H2O(l) △H=-571.6 kJ·mol-1,则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是_________________________,判断该反应自发进行的条件:_______________(填“高温自发”或“低温自发”)。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g)![]() 2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。

①则该反应的△H___0(填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在该图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线___。
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.

①能判断N2(g)+3H2(g)2NH3(g)达到平衡的是___(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②此时N2的平衡分压为_________MPa.(分压=总压×物质的量分数)。计算出此时的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银的冶炼有很多方法,在《天工开物》均有记载,而现代流行的“氰化法”,即 用NaCN溶液浸出矿石中的银的方法是常用的方法。该方法具备诸多优点:银的回收率高、对游离态和化合态的银均能浸出、对能源消耗相对较少,生产工艺简便等,但银化物通常有毒。其炼制工艺简介如下:
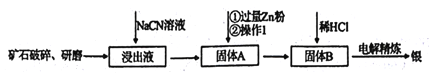
(1)矿石需要先进行破碎、研磨,其目的是_________。
(2)写出该工艺的一个明显的缺点____________。
(3)用NaCN浸泡矿石(该矿石是辉银矿,其主要成分是Ag2S)时,反应容器处于开口状态,产生的银以[Ag(CN)2]-形式存在,硫元素被氧化至最高价,试写出主要反应的离子方程式________。
(4)银往往和锌、铜、金等矿伴生,故氰化法得到的银中往往因含有上述金属而不纯净,需要进一步纯化,从而获得纯净的银。其中方法之一就是进行电解精炼,在精炼过程中,含有杂质的银作_______极(填“阴”或“阳”),该电极上发生的主要反应式为_____。
(5)有人提出了另外的提纯银的方案,先将锌粉还原后的混合金属用略过量的硝酸溶解,通 过精确调整溶液的pH来进行金属元素逐一分离,已知:
①溶解后的离子浓度如表:
Zn2+ | Cu2+ | Ag+ | |
物质的量浓度(mol/L) | 0.001 | 0.002 | 0.5 |
②某些金属离子的氢氧化物Ksp如表:
Zn2+ | Cu2+ | Ag+ | …… | |
Ksp | 1.0×10-17 | 2.0×10-20 | 2.0×10-8 |
(已知lg2=0.3),该设计方案 ______(填“可行”或“不可行”),其原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在2 L的恒容密闭容器中,气态A、B、C的物质的量n(mol)随时间t的变化如图所示。

(1)该反应的化学方程式____________________________________________________。
(2)在________________min时反应刚好达到平衡。
(3)在0~3minA物质的平均速率为_____________________,此时A物质的转化率为______,3min末时A物质的浓度为_____________。
(4)5~7 min内B的平均速率___________1~3min内B的平均速率(填大于、小于、等于)。
(5)下列措施可加快该反应速率的是__________。
A.扩大容器体积 B.使用恰当的催化剂 C.提高反应的温度 D.液化并转移出C物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M均为短周期主族元素,原子序数依次增大,X质子总数与电子层数相同,Y元素的一种同位素可用于考古时测定一些文物的年代,Z的气态氢化物可以与Cl2反应产生白烟,用来检验氯气管道是否泄漏。Y、Z、W位于同一周期,且最外层电子数之和为15,M的质子数是X、Y、Z、W四种元素质子数之和的1/2,下列说法正确的是
A. 简单离子半径M>W>Z>X
B. M2W2与足量的CO2完全反应,转移2mol电子时增重28g
C. X、Z两种元素只能组成化学式为ZX3的化合物
D. 由X、Y、Z、W四种元素形成的化合物既有共价化合物也有离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国C.Marchetin博士对世界一次能源替代趋势作了如图所示预测。回答下列问题:

(1)图中属于化石能源的有煤、石油和_____。
(2)目前采用铀核裂变方式获取核能,![]() 中含有的中子数为____;
中含有的中子数为____;![]() 与
与![]() 的关系是_____。
的关系是_____。
(3)太阳能是一种新能源,制造太阳能电池的材料有Si、Ga、As等。它们能用于制造太阳能电池是利用其____性质;Ga与As均是第四周期的主族元素,Ga与Al同主族,As与N同主族,则元素As、Ga的最高价氧化物对应水化物酸性较强的是____(填化学式)。
(4)近年来我国在南海成功试开采可燃冰,可燃冰释放的气体主要有CH4、少量乙烷、丙烷及丁烷等。丙烷完全燃烧的化学方程式为____;异丁烷的一氯取代物有___种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com