
【题目】X、Y、Z、W、M均为短周期主族元素,原子序数依次增大,X质子总数与电子层数相同,Y元素的一种同位素可用于考古时测定一些文物的年代,Z的气态氢化物可以与Cl2反应产生白烟,用来检验氯气管道是否泄漏。Y、Z、W位于同一周期,且最外层电子数之和为15,M的质子数是X、Y、Z、W四种元素质子数之和的1/2,下列说法正确的是
A. 简单离子半径M>W>Z>X
B. M2W2与足量的CO2完全反应,转移2mol电子时增重28g
C. X、Z两种元素只能组成化学式为ZX3的化合物
D. 由X、Y、Z、W四种元素形成的化合物既有共价化合物也有离子化合物
【答案】D
【解析】
X、Y、Z、W、M均为短周期主族元素,原子序数依次增大,X质子总数与电子层数相同,则X为H元素;Y元素的一种同位素可用于考古时测定一些文物的年代,Y为C;Z的气态氢化物可以与Cl2反应产生白烟,用来检验氯气管道是否泄漏,Z为N元素;Y、Z、W位于同一周期,且最外层电子数之和为15,W的最外层电子数为15-4-5=6,则W为O元素;M的质子数是X、Y、Z、W四种质子数之和的![]() ,M的质子数为(1+6+7+8)×
,M的质子数为(1+6+7+8)×![]() =11,则M为Na,以此来解答。
=11,则M为Na,以此来解答。
由上述分析可以知道,X为H,Y为C,Z为N,W为O,M为Na,
A.电子层越多,离子半径越大;电子层结构相同的离子,核电荷数越大,半径越小,则简单离子半径Z>W> M> X,故A错误;
B. 由反应式2Na2O2+2CO2=2Na2CO3+O2可知,转移2mol电子时增重56g,故B错误;
C. H、N两种元素组成的有NH3和N2H4等不止一种的化合物,故C错误;
D. 若由X、Y、Z、W四种元素组成的化合物为硝酸铵,则其既有离子键、又有共价键;若组成的化合物为硝酸,则其只含共价键,故D正确。
所以D选项是正确的。


科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
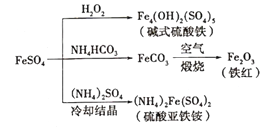
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B. 该温度下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,电池反应如下: PbO2 + Pb + 2H2SO4 ![]() 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
A. PbO2放电时是电池的负极,充电时是电池的阳极
B. 负极的电极反应式为:Pb + SO42—– 2e–=PbSO4
C. 放电时,PbO2得电子,被氧化
D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要配制2 mol·L-1的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
A.950 mL,111.2 gB.500 mL,117 g
C.1 000 mL,117 gD.任意规格,111.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是( )

A. BaCl2,CaCO3一定存在,NaOH可能存在
B. K2SO4、CuSO4一定不存在
C. K2SO4、NaOH、CaCO3、BaCl2一定存在,CuSO4可能存在
D. C为单一溶质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质:
A 金刚石与石墨;B 淀粉与纤维素;C 氕与氘;D 甲烷与戊烷; E 葡萄糖与果糖
F![]() 与
与 G
G  与
与
其中互为同位素 _____;(填编号.下同),互为同系物的是____,互为同分异构体的是______,是同一种物质的是________.
(2)化合物A的结构简式为: ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:_____;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为_____。
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:_____;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为_____。
(3)篮烷分子的键线式如图所示,试回答:

写出篮烷分子的化学式________;篮烷分子的一氯取代物的种数为______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基本化工原料,可制备乙酸乙酯,其转化关系如图.

已知:H2C=CH﹣OH不稳定
I ①的反应类型是___.请写出乙烯官能团名称_____, 由A生成B的化学方程式_____.
II 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。

已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点见下表:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用为_______;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式__________
(2)球形干燥管C的作用是______若反应前D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________;再加入(此空从下列选项中选择)________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A 五氧化二磷 B 碱石灰
C 无水硫酸钠 D 生石灰
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,还含有少量SiO2。现以卤块为原料按如图所示流程进行生产,用于制备金属镁。

请回答下列问题:
(1)步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施是____________(任写一条)。
(2)步骤②得到的X是___(填化学式),能够分离得到沉淀的方法是_____
(3)写出步骤④的化学方程式:_______
(4)步骤①中溶解卤块的盐酸如果过量太多造成的影响是____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有K+、Cl-、OH-、SO![]() 、SO
、SO![]() ,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。
,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是
①________,②________,③________,④__________,⑤__________。
(2)图中现象a、b、c表明检验出的离子分别是a________、b________、c________。
(3)白色沉淀A加试剂②反应的离子方程式_________________。
(4)无色溶液C加试剂③的主要目的是_____________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(6)气体E通入试剂④发生反应的离子方程式是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com