
| A、原子半径:A>B>C>D |
| B、原子序数:d>c>b>a |
| C、离子半径:C3->D->B+>A2+ |
| D、元素的第一电离能:A>B>D>C |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
| A、K+ 1s22s22p63s23p6 |
| B、As 1s22s22p63s23p64s24p3 |
| C、N3- 1s22s22p6 |
| D、Cr 1s22s22p63s23p63d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2g | B、1.6g |
| C、1g | D、1.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
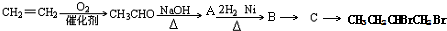
| NaOH |
| △ |
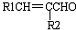 +H2O(-R1、R2表示氢原子或烃基)
+H2O(-R1、R2表示氢原子或烃基)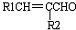
| 2H2、Ni |
| △ |
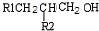
查看答案和解析>>
科目:高中化学 来源: 题型:
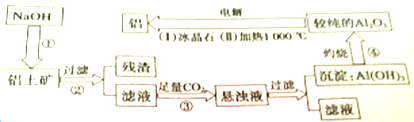
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LSO3含有的分子数等于0.1NA |
| B、1 mol CaC2所含阴离子数为2NA |
| C、常温常压下,16gO2 和O3的混合气体含有的氧原子数为NA |
| D、含有1mol Fe(OH)3的氢氧化铁胶体中胶粒数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 现象和结论 |
| 步骤一: | 若产生暗蓝色沉淀,则 |
| 步骤二: | 若乙醚层呈红色,则 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com