
| A、标准状况下,2.24LSO3含有的分子数等于0.1NA |
| B、1 mol CaC2所含阴离子数为2NA |
| C、常温常压下,16gO2 和O3的混合气体含有的氧原子数为NA |
| D、含有1mol Fe(OH)3的氢氧化铁胶体中胶粒数为NA |
| 16g |
| 16g/mol |


科目:高中化学 来源: 题型:
| A、全部 | B、除②⑦以外 |
| C、除②以外 | D、除⑨以外 |
查看答案和解析>>
科目:高中化学 来源: 题型:
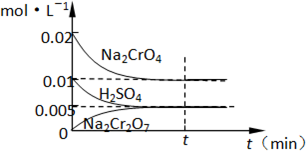 (1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:
(1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:A>B>C>D |
| B、原子序数:d>c>b>a |
| C、离子半径:C3->D->B+>A2+ |
| D、元素的第一电离能:A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子在核外运动时有确定的轨道和轨迹,电子云就是对其运动轨迹的准确描述 |
| B、原子核外电子在某一时刻的位置可以测定或计算出来 |
| C、人们常用小黑点的疏密程度来表示电子在原子核外出现的概率的大小 |
| D、电子云图中的小黑点表示电子的个数多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、①②⑤⑥ |
| C、②③⑤⑥ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:
将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com