
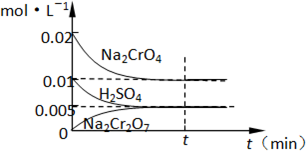
 (1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:
(1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:| c(Cr2O72-) |
| C2(CrO42-)×C(H+) |
| 5×10-3 |
| (1×10-2)2×1×10-2 |
| 9.0×10-12 |


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
| A、①③④⑤⑥ | B、①和⑥ |
| C、只有① | D、只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时储氢合金作正极 |
| B、充电时阳极周围c(OH-)增大 |
| C、放电时负极反应:LaNi5H6+6OH--6e-=LaNi5+6H2O |
| D、充电时储氢合金作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3做氧化剂 |
| B、N2是还原剂 |
| C、AlN既是氧化产物又是还原产物 |
| D、若有1mol CO生成,则反应中有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2g | B、1.6g |
| C、1g | D、1.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
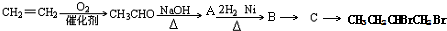
| NaOH |
| △ |
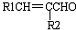 +H2O(-R1、R2表示氢原子或烃基)
+H2O(-R1、R2表示氢原子或烃基)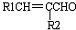
| 2H2、Ni |
| △ |
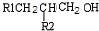
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LSO3含有的分子数等于0.1NA |
| B、1 mol CaC2所含阴离子数为2NA |
| C、常温常压下,16gO2 和O3的混合气体含有的氧原子数为NA |
| D、含有1mol Fe(OH)3的氢氧化铁胶体中胶粒数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com