


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
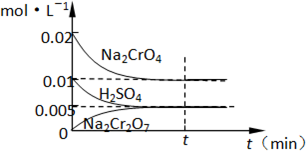 (1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:
(1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2+SO2═Na2SO4 |
| B、2Na2O2+2CO2═2Na2CO3 +O2↑ |
| C、2Na2O2+2H2O═4NaOH+O2↑ |
| D、5Na2O2+MnO4-+16H+═10Na++2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:
将镁和铝的混合物0.1mol溶于100ml2mol/L的H2SO4 溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com