

| 1 |
| 1 |
| 7 |
| 14 |
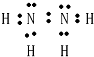 ,已知25℃,0.4mol液态甲和O2完全反应(产物对环境无污染)放出248.8kJ的热量,则1molN2H4和O2完全反应放出622kJ的热量,所以该反应的热化学方程式N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-622kJ?mol-1,
,已知25℃,0.4mol液态甲和O2完全反应(产物对环境无污染)放出248.8kJ的热量,则1molN2H4和O2完全反应放出622kJ的热量,所以该反应的热化学方程式N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-622kJ?mol-1,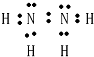 ;N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-622kJ?mol-1;
;N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-622kJ?mol-1;| 528.7 |
| 622 |
| △c |
| t |
| 4×10-2 |
| 40 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、Al2O3做氧化剂 |
| B、N2是还原剂 |
| C、AlN既是氧化产物又是还原产物 |
| D、若有1mol CO生成,则反应中有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| B、Ca(HCO3)2溶液中加入足量NaOH溶液:HCO3-+OH-=H2O+CO32- |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| D、氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤⑦⑧ |
| B、①③⑤⑧⑨ |
| C、①②③⑤⑥⑦ |
| D、③⑤⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
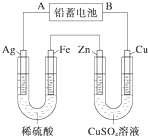 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B、0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C、含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KMnO4,H2SO4,AlCl3 |
| B、NaClO,MgCl2,HNO3 |
| C、NaCl,NaClO4,NaClO3,Na2SO4 |
| D、KClO3,KCl,H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com