
【题目】下图所示是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液。已知放电时电池反应为Pb+PbO2+4H++2![]() =2PbSO4+2H2O,下列有关说法正确的是( )
=2PbSO4+2H2O,下列有关说法正确的是( )

A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,H+向Pb电极区迁移
C.K与M相接时,所用电源的a极为正极
D.K与M相接时,阳极附近的pH逐渐减小
【答案】D
【解析】
K与N相接时,为原电池反应,放电时,铅失电子发生氧化反应而作负极,电极反应式为Pb-2e-+SO42-=PbSO4,二氧化铅得电子作正极,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,电解质溶液中阳离子向正极移动,阴离子向负极移动,K与M连接时,为电解池装置,电解池中的Pb为阴极连接电源的负极,阳极是PbO2,结合电极方程式解答该题.
A.K与N相接时是原电池,Pb做负极,PbO2做正极,能量变化为化学能转化为电能,故A错误;
B.K与N相接时是原电池,Pb做负极,PbO2做正极,氢离子移向正极,故B错误;
C.K与M连接时,装置是电解池,电解池中的Pb为阴极连接电源的负极,故C错误;
D.K与M连接时,装置是电解池,阳极是PbO2,电解方程式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,阳极附近的pH逐渐减小,故D正确;
故选:D。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】对反应3SO2(g) + 2H2O(g)![]() 2H2SO4(l) + S(s) △H,在某一投料比,不同条件下达平衡时,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
2H2SO4(l) + S(s) △H,在某一投料比,不同条件下达平衡时,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
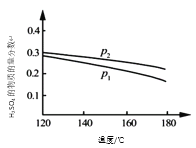
(1)p2___ p1(填“>”或“<”),得出该结论的理由是____。
(2)为了提高SO2的平衡转化率,可采取适当增大压强、_____、______(任意补充两个合理措施)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(l)△H=﹣132kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l)△H=﹣132kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
H2(g) | N2(g) | NH3(g) | |
1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,下列说法正确的是

A.上图可表示合成氨过程中的能量变化
B.a的数值为1173
C.Q的数值为92
D.其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取H2.下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) △H1=+571.6kJmol﹣1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) △H2=+131.3kJmol﹣1
③甲烷与水反应制氢:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
A. 反应CH4(g)= C(s)+2 H2(g)的△H=+74.8kJmol﹣1 。
B. 电解水也可制取氢气和氧气,而且比方法①更方便,更节能。
C. 反应②每生成2g氢气,要吸收131.3kJ的热量,所以该反应没有应用价值。
D. 反应③中,若将各1mol的甲烷与水蒸气混合,要吸收206.1kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]()
![]()
![]()
下列表述正确的是NA代表阿伏加德罗常数的数值![]()
![]()
A.![]() 燃烧时放出的热量为
燃烧时放出的热量为![]()
B.![]()
![]()
C.![]() 与
与![]() 反应放出
反应放出![]() 热量时电子转移数为
热量时电子转移数为![]()
D.![]() 和
和![]() 中阴阳离子个数比不同
中阴阳离子个数比不同
查看答案和解析>>
科目:高中化学 来源: 题型:
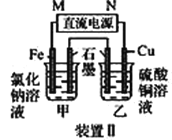
【题目】如图所示2套实验装置,分别回答下列问题。
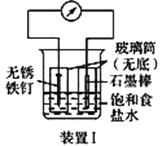
(1)装置Ⅰ为铁的吸氧腐蚀实验。一段时间后,铁被________(填“ 氧化”或“还原”); 向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨附近的溶液变红,该电极反应为______________________________________。
(2)装置Ⅱ中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到铁片电极附近首先变红。电源的M端为________(填“正”或“负”)极,甲烧杯中铁电极的电极反应为____________,停止电解,乙中________电极质量增加。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下重水(D2O)的离子积常数为1.6×10-15,用定义pH一样来规定pD=-lg{c(D+)},则该温度下,下列叙述正确的是
A.纯净的重水(D2O)中,pD=7
B.1 L溶解有0.01 mol DCl的重水溶液,其pD=12.0
C.纯净的重水中,c(D+)=c(OD-)
D.1 L溶解有0.01 mol NaOD的重水溶液,其pD=12.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述正确的是

A. 用图1装置将氯化铁溶液直接蒸干得到氯化铁固体
B. 利用图2装置可制备Fe(OH)2
C. 图3微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 利用图4可收集氯化氢并进行尾气吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度(T)时,X2(g)和H2反应生成HX的平衡常数如下表。
化学方程式 | K(T) |
F2+H2 | 1.8×1036 |
Cl2+H2 | 9.7×1022 |
Br2+H2 | 5.6×107 |
I2+H2 | 43 |
(1)I 有多种同位素,![]() 的中子数为______。
的中子数为______。
(2)用电子式表示HCl的形成过程______。
(3)下列说法正确的是______。
a 共价键的极性:HF>HCl
b 氯和溴氢化物性质的热稳定性:HCl>HBr
c 原子半径:S<Cl
d 酸性:H2SO4<HClO
(4)K的变化体现出X2化学性质的递变性,用原子结构解释X2得电子能力变化的原因______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com