
【题目】对反应3SO2(g) + 2H2O(g)![]() 2H2SO4(l) + S(s) △H,在某一投料比,不同条件下达平衡时,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
2H2SO4(l) + S(s) △H,在某一投料比,不同条件下达平衡时,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
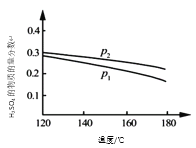
(1)p2___ p1(填“>”或“<”),得出该结论的理由是____。
(2)为了提高SO2的平衡转化率,可采取适当增大压强、_____、______(任意补充两个合理措施)。
【答案】> 相同温度下,压强从P1到P2时H2SO4的物质的量分数增大,说明平衡向右移动,而向右是气体体积缩小的方向,说明压强的变化是增大了,所以P2>P1 降低温度 充入H2O(g)(其余合理答案也可)
【解析】
(1)从反应方程式看,反应物分子都为气体,而生成物分子都为非气体;从图中可以看出,p2时H2SO4的物质的量分数大,依据平衡移动原理,可确定p2与 p1的大小关系。
(2)由图中信息,可确定温度变化对H2SO4的物质的量分数的影响。为了提高SO2的平衡转化率,可采取适当增大压强、改变温度、加入反应物或取出生成物等。
(1)从反应方程式看3SO2(g) + 2H2O(g)![]() 2H2SO4(l) + S(s),反应物分子都为气体,而生成物分子都为非气体;从图中可以看出,p2时H2SO4的物质的量分数大。依据平衡移动原理,加压,平衡正向移动,产物的物质的量分数大,所以p2>p1;得出该结论的理由是相同温度下,压强从P1到P2时H2SO4的物质的量分数增大,说明平衡向右移动,而向右是气体体积缩小的方向,说明压强的变化是增大了,所以P2>P1。答案为:>;相同温度下,压强从P1到P2时H2SO4的物质的量分数增大,说明平衡向右移动,而向右是气体体积缩小的方向,说明压强的变化是增大了,所以P2>P1;
2H2SO4(l) + S(s),反应物分子都为气体,而生成物分子都为非气体;从图中可以看出,p2时H2SO4的物质的量分数大。依据平衡移动原理,加压,平衡正向移动,产物的物质的量分数大,所以p2>p1;得出该结论的理由是相同温度下,压强从P1到P2时H2SO4的物质的量分数增大,说明平衡向右移动,而向右是气体体积缩小的方向,说明压强的变化是增大了,所以P2>P1。答案为:>;相同温度下,压强从P1到P2时H2SO4的物质的量分数增大,说明平衡向右移动,而向右是气体体积缩小的方向,说明压强的变化是增大了,所以P2>P1;
(2)从图中可以看出,升高温度,H2SO4的物质的量分数减小,则表明正反应为放热反应。为了提高SO2的平衡转化率,可采取适当增大压强、降温、加入反应物或取出生成物等。答案为:降低温度;充入H2O(g)(其余合理答案也可)。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列关于该有机物的说法正确的是
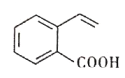
A. 1mol 该有机物最多与4molH2反应生成C9H16O2
B. 该有机物中所有碳原子不可能处于同一平面上
C. 该有机物能发生酯化、加成、氧化、水解等反应
D. 与该有机物具有相同官能团的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氧化锌作催化剂、以乙二醇和碳酸氢钠为复合解聚剂常压下快速、彻底解聚聚对苯二甲酸乙二醇酯,同时回收对苯二甲酸和乙二醇。反应原理如下:

实验步骤如下:
步骤1:在题图1所示装置的四颈烧瓶内依次加入洗净的矿泉水瓶碎片、氧化锌、碳酸氢钠和乙二醇,缓慢搅拌,油浴加热至180 ℃,反应0.5 h。

步骤2:降下油浴,冷却至160 ℃,将搅拌回流装置改为图2所示的搅拌蒸馏装置,水泵减压,油浴加热蒸馏。
步骤3:蒸馏完毕,向四颈烧瓶内加入沸水,搅拌。维持温度在60 ℃左右,抽滤。
步骤4:将滤液转移至烧杯中加热煮沸后,趁热边搅拌边加入盐酸酸化至pH为1~2。用砂芯漏斗抽滤,洗涤滤饼数次直至洗涤滤液pH=6,将滤饼摊开置于微波炉中微波干燥。
请回答下列问题:
(1) 步骤1中将矿泉水瓶剪成碎片的目的是______________________________。
(2) 步骤2中减压蒸馏的目的是____________________,蒸馏出的物质是________。
(3) 抽滤结束后停止抽滤正确的操作方法是________。若滤液有色,可采取的措施是________。
(4) 该实验中,不采用水浴加热的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硝酸锰[Mn(NO3)2]制备的一种含锰催化剂,常温下能去除甲醛、氢氰酸(HCN)等有毒气体。
(1) Mn2+基态核外电子排布式是________________。NO3-的空间构型为__________________(用文字描述)
(2) 甲醛分子中,碳原子的杂化方式为________。
(3) HCN分子中σ键与π键的数目比为________。H、C、N三种元素的电负性由大到小的顺序为________。
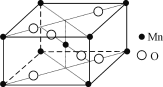
(4) 硝酸锰受热可分解生成NO2和某种锰的氧化物。该氧化物晶胞结构如右图所示。写出硝酸锰受热分解的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M、N、Q的转化关系为:
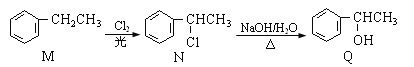
下列说法正确的是( )
A.M分子中的所有原子均在同一平面
B.上述两步反应依次属于加成反应和取代反应
C.M的同分异构体中属于芳香烃的还有3种
D.Q与乙醇互为同系物,且均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
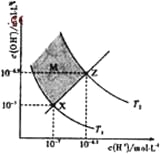
A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是( )
A. K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大
B. 比较Ksp与离子积Qc的相对大小,可判断难溶解电解质在给定条件下沉淀能否生成或溶解
C. K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了
D. 弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka·Kh
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液。已知放电时电池反应为Pb+PbO2+4H++2![]() =2PbSO4+2H2O,下列有关说法正确的是( )
=2PbSO4+2H2O,下列有关说法正确的是( )

A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,H+向Pb电极区迁移
C.K与M相接时,所用电源的a极为正极
D.K与M相接时,阳极附近的pH逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com