
【题目】某有机物的结构简式如图所示。下列关于该有机物的说法正确的是
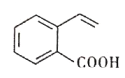
A. 1mol 该有机物最多与4molH2反应生成C9H16O2
B. 该有机物中所有碳原子不可能处于同一平面上
C. 该有机物能发生酯化、加成、氧化、水解等反应
D. 与该有机物具有相同官能团的同分异构体有3种
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式_________.已知25℃时,CO32﹣第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO3﹣):c(CO32﹣)=20:1 时,溶液的pH=_____.
②泡沫灭火器中通常装有NaHCO3 溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________.
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmolL﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为___________(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1).可使溶液A和溶液B的 pH相等的方法是_____.
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:

①图中pH=7时,溶液中离子浓度关系正确的是___。
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3![]() H++ HSO3﹣的平衡常数的数值____.
H++ HSO3﹣的平衡常数的数值____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁红(Fe2O3)常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为Fe2O3、Fe3O4,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:
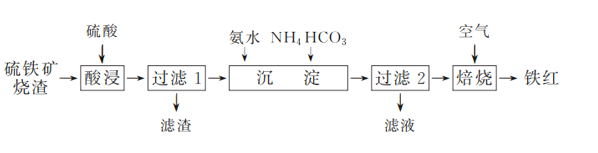
已知:某些过渡元素(如Cu、Fe、Ag等)的离子能与NH3、H2O、OH-、SCN-等形成可溶性配合物。
(1) 工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是________。
(2) “酸浸”时加入的硫酸不宜过量太多的原因是________。
(3) “过滤1”所得滤液中含有的阳离子有________。
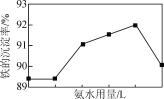
(4) “沉淀”过程中,控制NH4HCO3用量不变,铁的沉淀率随氨水用量变化如右图所示。当氨水用量超过一定体积时,铁的沉淀率下降。其可能的原因是________。
(5) “过滤2”所得滤渣的主要成分为FeOOH和FeCO3,所得滤液中的主要溶质是________(填化学式)。
(6) 写出FeCO3在空气中焙烧生成铁红的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种电解质溶液可以循环流动的新型电池。下列说法正确的是
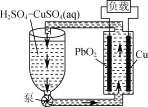
A.Cu电极为正极
B.PbO2电极反应式为PbO2+2e-+4H+=Pb2++2H2O
C.放电后循环液中H2SO4与CuSO4物质的量之比变小
D.若将Cu换成Pb,则电路中电子转移方向改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为
Fe2O3(s)+CO(g)![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH____(填“>”“<”或“=”)0。
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=____、CO的平衡转化率=____。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是____。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物m、n、P存在如下转化关系。下列说法正确的是

A. m、n不存在同分异构体,p存在多种同分异构体
B. m、n、p均能使酸性高锰酸钾溶液褪色
C. m、n、p中所有原子可能共面
D. 等质量的m、n、p,完全燃烧耗氧量不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgSO4·7H2O是一种重要的化工原料,某研究性学习小组设计了利用菱镁矿石(主要成分是MgCO3,并含有MnCO3、SiO2)制取MgSO4·7H2O的实验流程如下:

已知:Mn2++ClOˉ+H2O=MnO2↓+Clˉ+2H+
(1)过滤1的滤渣主要成分是______。
(2)酸浸时MgCO3发生反应的离子反应方程式为:_________________________。
(3)操作1经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤才可得到产品,检验产品是否洗涤干净的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应3SO2(g) + 2H2O(g)![]() 2H2SO4(l) + S(s) △H,在某一投料比,不同条件下达平衡时,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
2H2SO4(l) + S(s) △H,在某一投料比,不同条件下达平衡时,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
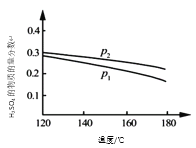
(1)p2___ p1(填“>”或“<”),得出该结论的理由是____。
(2)为了提高SO2的平衡转化率,可采取适当增大压强、_____、______(任意补充两个合理措施)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(l)△H=﹣132kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l)△H=﹣132kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
H2(g) | N2(g) | NH3(g) | |
1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,下列说法正确的是

A.上图可表示合成氨过程中的能量变化
B.a的数值为1173
C.Q的数值为92
D.其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com