
【题目】MgSO4·7H2O是一种重要的化工原料,某研究性学习小组设计了利用菱镁矿石(主要成分是MgCO3,并含有MnCO3、SiO2)制取MgSO4·7H2O的实验流程如下:

已知:Mn2++ClOˉ+H2O=MnO2↓+Clˉ+2H+
(1)过滤1的滤渣主要成分是______。
(2)酸浸时MgCO3发生反应的离子反应方程式为:_________________________。
(3)操作1经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤才可得到产品,检验产品是否洗涤干净的方法是_______________。
【答案】SiO2 MgCO3 +2H+===Mg2+ + CO2↑+H2O 取最后几滴洗涤液于试管中,并滴加稀硝酸酸化的硝酸银溶液,若无白色沉淀生成,则产品已洗涤干净
【解析】
(1)在菱镁矿石中,MgCO3、MnCO3与硫酸都能反应,但SiO2不反应,从而得出过滤1的滤渣主要成分。
(2)酸浸时MgCO3与硫酸反应,生成硫酸镁、水和二氧化碳气体。
(3)操作1经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤才可得到产品,检验产品是否洗涤干净的方法是检验Cl-是否存在。
(1)在菱镁矿石中,MgCO3、MnCO3与硫酸都能反应,但SiO2不反应,从而得出过滤1的滤渣主要成分是SiO2。答案为:SiO2;
(2)酸浸时MgCO3与硫酸反应,生成硫酸镁、水和二氧化碳气体。发生反应的离子反应方程式为MgCO3+2H+==Mg2+ + CO2↑+H2O。答案为:MgCO3+2H+==Mg2+ + CO2↑+H2O;
(3)操作1经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤才可得到产品,检验产品是否洗涤干净的方法是取最后几滴洗涤液于试管中,并滴加稀硝酸酸化的硝酸银溶液,若无白色沉淀生成,则产品已洗涤干净。答案为:取最后几滴洗涤液于试管中,并滴加稀硝酸酸化的硝酸银溶液,若无白色沉淀生成,则产品已洗涤干净。


科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2-二溴乙烷,装置如下图所示:
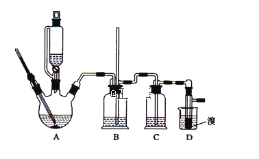
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)写出由乙醇制备乙烯的化学方程式______________________________,乙烯制备1,2-二溴乙烷的化学方程式_______________________________。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___________;(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置A中除了浓硫酸和乙醇外,还应加入_____,其目的是_______装置A中生成副产物乙醚的化学反应方程式 ___________________。
(4)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,为了验证二氧化硫的存在并除去二氧化硫对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放 ________________,
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液d.品红和酸性KMnO4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层(填“上”、“下”);若产物中有少量副产物乙醚。可用_______的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO2+2NH3![]() CO(NH2)2+H2O可应用于工业合成尿素。下列表示反应中相关微粒的化学用语正确的是
CO(NH2)2+H2O可应用于工业合成尿素。下列表示反应中相关微粒的化学用语正确的是
A.中子数为8的碳原子:![]() CB.NH3的电子式:
CB.NH3的电子式:![]()
C.氧原子的结构示意图:![]() D.CO(NH2)2的结构简式:
D.CO(NH2)2的结构简式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列关于该有机物的说法正确的是
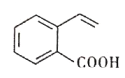
A. 1mol 该有机物最多与4molH2反应生成C9H16O2
B. 该有机物中所有碳原子不可能处于同一平面上
C. 该有机物能发生酯化、加成、氧化、水解等反应
D. 与该有机物具有相同官能团的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题。

(1)表中元素,金属性最强的元素是_______,非金属性最强的元素是_______;(填元素名称)
(2)Ar原子结构示意图为__________;
(3)沼气的主要成分是_____________(填化学式);
(4)在第3周期元素中,最高价氧化物对应水化物酸性最强的是__________(填化学式),最高价氧化物对应水化物碱性最强的是____________(填化学式),形成的气态氢化物中,最稳定的是____________(填化学式);
(5)C和N中,原子半径较小的是__________;
(6)“高钙牛奶”中的钙是指__________(填“元素”或“单质”);
(7)Si是带来人类文明的重要元素之一,其氧化物常用于制造__________ (填一种高性能的现代通讯材料的名称);
(8)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为__________;
(9)O元素形成的一种氢化物的化学式是__________ ,该物质中H元素与O元素的质量比为__________ 。(相对原子质量:H-1 ; O-16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氧化锌作催化剂、以乙二醇和碳酸氢钠为复合解聚剂常压下快速、彻底解聚聚对苯二甲酸乙二醇酯,同时回收对苯二甲酸和乙二醇。反应原理如下:

实验步骤如下:
步骤1:在题图1所示装置的四颈烧瓶内依次加入洗净的矿泉水瓶碎片、氧化锌、碳酸氢钠和乙二醇,缓慢搅拌,油浴加热至180 ℃,反应0.5 h。

步骤2:降下油浴,冷却至160 ℃,将搅拌回流装置改为图2所示的搅拌蒸馏装置,水泵减压,油浴加热蒸馏。
步骤3:蒸馏完毕,向四颈烧瓶内加入沸水,搅拌。维持温度在60 ℃左右,抽滤。
步骤4:将滤液转移至烧杯中加热煮沸后,趁热边搅拌边加入盐酸酸化至pH为1~2。用砂芯漏斗抽滤,洗涤滤饼数次直至洗涤滤液pH=6,将滤饼摊开置于微波炉中微波干燥。
请回答下列问题:
(1) 步骤1中将矿泉水瓶剪成碎片的目的是______________________________。
(2) 步骤2中减压蒸馏的目的是____________________,蒸馏出的物质是________。
(3) 抽滤结束后停止抽滤正确的操作方法是________。若滤液有色,可采取的措施是________。
(4) 该实验中,不采用水浴加热的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硝酸锰[Mn(NO3)2]制备的一种含锰催化剂,常温下能去除甲醛、氢氰酸(HCN)等有毒气体。
(1) Mn2+基态核外电子排布式是________________。NO3-的空间构型为__________________(用文字描述)
(2) 甲醛分子中,碳原子的杂化方式为________。
(3) HCN分子中σ键与π键的数目比为________。H、C、N三种元素的电负性由大到小的顺序为________。
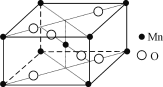
(4) 硝酸锰受热可分解生成NO2和某种锰的氧化物。该氧化物晶胞结构如右图所示。写出硝酸锰受热分解的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
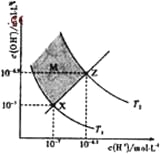
A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年,节能减排、提高原料利用率来提高经济效益成为人们关注的焦点。某化工厂利用甲烷与氯气反应得到的副产品来制取盐酸实现了变废为宝的梦想,其生产原理可在实验室中模拟如图,请根据要求填空:

(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③__________。
(2)设![]() =x,若理论上欲获得最多的氯化氢,则x值应_________。
=x,若理论上欲获得最多的氯化氢,则x值应_________。
(3)在C装置中,经过一段时间的强光照射后,发现硬质玻璃管内壁附着有油珠,生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O2![]() 2COCl2+2HCl,上述反应__________ (填选项符号,下同)。
2COCl2+2HCl,上述反应__________ (填选项符号,下同)。
A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是____________。
A.氢氧化钠溶液 B.硝酸银溶液
C.稀盐酸 D.水
E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
(4)D装置的石棉中均匀混有KI粉末,其作用是___________。
(5)E装置的作用是____________ (填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为_____________;该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为_____ (填编号)。
①CH4 ②CH3Cl ③CH2Cl2 ④CHCl3 ⑤CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com