
【题目】下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题。

(1)表中元素,金属性最强的元素是_______,非金属性最强的元素是_______;(填元素名称)
(2)Ar原子结构示意图为__________;
(3)沼气的主要成分是_____________(填化学式);
(4)在第3周期元素中,最高价氧化物对应水化物酸性最强的是__________(填化学式),最高价氧化物对应水化物碱性最强的是____________(填化学式),形成的气态氢化物中,最稳定的是____________(填化学式);
(5)C和N中,原子半径较小的是__________;
(6)“高钙牛奶”中的钙是指__________(填“元素”或“单质”);
(7)Si是带来人类文明的重要元素之一,其氧化物常用于制造__________ (填一种高性能的现代通讯材料的名称);
(8)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为__________;
(9)O元素形成的一种氢化物的化学式是__________ ,该物质中H元素与O元素的质量比为__________ 。(相对原子质量:H-1 ; O-16)
【答案】Ca O  CH4 HClO4 NaOH HCl N 元素 光导纤维 MgCl2= Mg+Cl2↑ H2O 1:8
CH4 HClO4 NaOH HCl N 元素 光导纤维 MgCl2= Mg+Cl2↑ H2O 1:8
【解析】
(1)同一周期中,元素的金属性随着原子序数的增大而减弱,同一主族中,所以的金属性随着原子序数的增大而增强,在元素周期表中,金属性最强的元素在左下角,则这几种元素中金属性最强的是Ca元素,同一周期非金属性随着原子序数的增大而增强,同一主族非金属性随着原子序数的减小而增强,故非金属性最强的是氧,故答案为:Ca,O;
(2)Ar原子核外有3个电子层,其K、L、M电子层上电子数分别是2、8、8,其原子结构示意图为: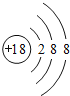 ,故答案为:
,故答案为: ;
;
(3)沼气的主要成分是甲烷CH4,故答案为:CH4;
(4)同一周期中,元素的非金属性随着原子序数的增大而增强(Ar除外),元素的非金属性越强,其最高价氧化物的水化物酸性越强,形成的气态氢化物越稳定,所以第三周期中,元素非金属性最强的元素是Cl元素,所以HClO4的酸性最强,HCl最稳定,同理,元素的金属性越强,最高价氧化物对应水化物碱性越强,所以NaOH碱性最强,其故答案为:HClO4,NaOH,HCl
(4)同一周期中,元素的原子半径随着原子序数的增大而减小,所以C元素的原子半径大于N,所以原子半径较小的是N原子,故答案为:N;
(5)“高钙牛奶”中的钙指元素,故答案为:元素;
(6)SiO2是光导纤维的主要成分,所以二氧化硅常用于制造光导纤维,故答案为:光导纤维;
(7)电解熔融氯化镁生成氯气和镁,反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(8)O元素形成的一种氢化物的化学式是H2O,该物质中H元素与O元素的质量比= ![]()
故答案为:1:8。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下图所示。下列叙述正确的是

A. 有机物A可与溴水发生加成反应
B. 1mol有机物A能消耗2molNaOH
C. 有机物A不能使酸性高锰酸钾溶液褪色
D. 有机物A分子中所有碳原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯(如图所示)是一种食用香料。
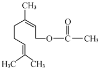
(1)乙酸橙花酯属于______(填“无机化合物”或“有机化合物”)。
(2)乙酸橙花酯中的官能团有________、_______(填名称)。
(3)将乙酸橙花酯加入饱和碳酸钠溶液中,充分震荡后分层,油层在上,说明乙酸橙花酯的密度___水的密度(填“大于”“小于”)。
(4)向乙酸橙花酯溶液中滴入几滴溴水,实验现象为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为
Fe2O3(s)+CO(g)![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH____(填“>”“<”或“=”)0。
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=____、CO的平衡转化率=____。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是____。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和过程可以达到实验目的的是
选项 | 实验目的 | 实验操作和过程 |
A | 取20.00 mL盐酸 | 在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸全部放入锥形瓶 |
B | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 |
C | 探究铁的吸氧腐蚀 | 将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中
|
D | 证明 Ksp(CuS)<Ksp(ZnS) | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,生成黑色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgSO4·7H2O是一种重要的化工原料,某研究性学习小组设计了利用菱镁矿石(主要成分是MgCO3,并含有MnCO3、SiO2)制取MgSO4·7H2O的实验流程如下:

已知:Mn2++ClOˉ+H2O=MnO2↓+Clˉ+2H+
(1)过滤1的滤渣主要成分是______。
(2)酸浸时MgCO3发生反应的离子反应方程式为:_________________________。
(3)操作1经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤才可得到产品,检验产品是否洗涤干净的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物环丙叉环丙烷,由于其特殊的电子结构一直受到理论化学家的注意,如下图是它的结构示意图。下列关于环丙叉环丙烷的有关说法中不正确的是
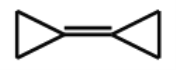
A. 环丙叉环丙烷的分子式为C6Hl0
B. 环丙叉环丙烷不是环丙烷的同系物
C. 环丙叉环丙烷的一氯取代物有2种
D. 环丙叉环丙烷所有的碳原子均在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com