
【题目】乙酸橙花酯(如图所示)是一种食用香料。
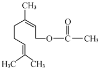
(1)乙酸橙花酯属于______(填“无机化合物”或“有机化合物”)。
(2)乙酸橙花酯中的官能团有________、_______(填名称)。
(3)将乙酸橙花酯加入饱和碳酸钠溶液中,充分震荡后分层,油层在上,说明乙酸橙花酯的密度___水的密度(填“大于”“小于”)。
(4)向乙酸橙花酯溶液中滴入几滴溴水,实验现象为________________。
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法不正确的是
A.苯和乙烯均可以使溴水褪色,但褪色原理不同
B.乳酸薄荷醇酯![]()
![]()
![]() 能发生水解、氧化、消去反应
能发生水解、氧化、消去反应
C.分子式为C4H11N的有机物,同分异构体有8种(不包括立体异构)
D.在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明有乙酸剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是( )

A.40 ℃之前,温度升高反应速率加快,变蓝时间变短
B.40 ℃之后溶液变蓝的时间随温度的升高变长
C.图中b、c两点对应的NaHSO3的反应速率相等
D.图中a点对应的NaHSO3的反应速率为5.0×10-5mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:

(1) “焙烧”时,提高反应速率的措施有____________(写一条)。
(2)炉气中的有害气体成分是__________。
(3)若试剂X是H2O2溶液,写出相应反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
B. 增大压强可加快SO2转化为SO3的速率
C. 黄绿色的氯水光照后颜色变浅
D. 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO2+2NH3![]() CO(NH2)2+H2O可应用于工业合成尿素。下列表示反应中相关微粒的化学用语正确的是
CO(NH2)2+H2O可应用于工业合成尿素。下列表示反应中相关微粒的化学用语正确的是
A.中子数为8的碳原子:![]() CB.NH3的电子式:
CB.NH3的电子式:![]()
C.氧原子的结构示意图:![]() D.CO(NH2)2的结构简式:
D.CO(NH2)2的结构简式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.由CH4、O2和KOH溶液组成的燃料电池,负极反应为CH4+8OH--8e-=CO2+6H2O
B.常温下,反应2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)能自发进行,该反应ΔH<0
C.反应C(s)+H2O(g)![]() CO(g)+H2(g)达平衡后,缩小容器体积,H2O(g)平衡转化率不变
CO(g)+H2(g)达平衡后,缩小容器体积,H2O(g)平衡转化率不变
D.0.1 mol·L-1 NH4Cl溶液加水稀释,![]() 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题。

(1)表中元素,金属性最强的元素是_______,非金属性最强的元素是_______;(填元素名称)
(2)Ar原子结构示意图为__________;
(3)沼气的主要成分是_____________(填化学式);
(4)在第3周期元素中,最高价氧化物对应水化物酸性最强的是__________(填化学式),最高价氧化物对应水化物碱性最强的是____________(填化学式),形成的气态氢化物中,最稳定的是____________(填化学式);
(5)C和N中,原子半径较小的是__________;
(6)“高钙牛奶”中的钙是指__________(填“元素”或“单质”);
(7)Si是带来人类文明的重要元素之一,其氧化物常用于制造__________ (填一种高性能的现代通讯材料的名称);
(8)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为__________;
(9)O元素形成的一种氢化物的化学式是__________ ,该物质中H元素与O元素的质量比为__________ 。(相对原子质量:H-1 ; O-16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物N(![]() )是一种常见的有机合成中间体,在生产中用途广泛。
)是一种常见的有机合成中间体,在生产中用途广泛。
有机物A为原料合成M和N的路线如下所示:

已知:I.R-CH=CH2+HBr ![]() R-CH2CH2Br
R-CH2CH2Br
II.R-CH2-CN![]() R-CH2-COOH
R-CH2-COOH ![]()
![]()
请回答下列问题:
(1)A分子中共面的原子数最多为___________个,-CN的电子式为___________。
(2)②的反应类型为___________,E分子中所含官能团的名称为___________,G的结构简式为______________________。
(3)写出反应⑤的化学方程式__________________________。
(4)写出M在酸性条件下水解的化学方程式______________________。
(5)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有___________种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的一种同分异构体的结构简式:___________。
(6)结合信息,写出用E和乙醇为原料制备化合物N的合成路线:(其他试剂任选)___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com