
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是( )

A.40 ℃之前,温度升高反应速率加快,变蓝时间变短
B.40 ℃之后溶液变蓝的时间随温度的升高变长
C.图中b、c两点对应的NaHSO3的反应速率相等
D.图中a点对应的NaHSO3的反应速率为5.0×10-5mol·L-1·s-1
【答案】C
【解析】
A、根据图像,40℃以前由80s逐渐减小,说明温度升高反应速率加快,故A说法正确;
B、根据图像,40℃之后,溶液变蓝的时间随温度的升高变长,故B说法正确;
C、40℃以前,温度越高,反应速率越快,40℃以后温度越高,变色时间越长,反应越慢,可以判断出40℃前后发生的化学反应不同,虽然变色时间相同,但不能比较化学反应速率,故C说法错误;
D、混合前NaHSO3的浓度为0.020mol·L-1,忽略混合前后溶液体积的变化,根据c1V1=c2V2,混合后NaHSO3的浓度为![]() =0.0040mol·L-1,a点溶液变蓝时间为80s,因为NaHSO3不足或KIO3过量,NaHSO3浓度由0.0040mol·L-1变为0,根据化学反应速率表达式,a点对应的NaHSO3反应速率为
=0.0040mol·L-1,a点溶液变蓝时间为80s,因为NaHSO3不足或KIO3过量,NaHSO3浓度由0.0040mol·L-1变为0,根据化学反应速率表达式,a点对应的NaHSO3反应速率为![]() =5.0×10-5mol/(L·s),故D说法正确;
=5.0×10-5mol/(L·s),故D说法正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】已知:原子序数小于18的同一主族的两种元素X和Y,其原子半径:X<Y。下列说法正确的是
A. 若X和Y均位于VIIA,则键能大小为HX<HY
B. 若X和Y均位于VIA,则H2X分子间易形成氢键
C. 若X和Y均位于IVA,则二者最高价氧化物的晶体类型相同
D. 若X和Y均位于IIA,则第一电离能大小为X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年12月1日国际纯粹与应用化学联合会宣布,将合成的四种新元素命名为113号 (缩写为Nh)、115号(Mc)、117号(Ts)和118号(Og)。下列说法正确的是
A. 113号元素的氧化物为两性氧化物
B. 115号元素位于第六周期第VA族
C. 117号元素的某种原子,核内含176个中子,此原子是![]() Ts
Ts
D. 118号元素的原子最外层有8个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X的一种氢化物与其最高价氧化物对应水化物反应生成盐。下列说法正确的是
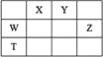
A. X的氢化物的沸点一定低于同主族元素形成的其他氢化物
B. 由Y、Z和氢三种元素形成的化合物中,Z的化合价越高氧化性越强
C. W的氧化物是酸性氧化物,能与碱、水反应,不能与酸反应
D. T元素单质具有半导体的特性,T与Y元素可形成两种化合物TY和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是_____(填元素符号);⑩元素符号为_____;
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐 M,M 中含有的化学键类型有_____;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_____。
(4)③、⑤、⑦、⑧所形成的离子,其半径由小到大的顺序是_____(填离子符号)。
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____(填物质化学式);呈两性的氢氧化物是_____(填物质化学式),该化合物与NaOH 溶液反应的离子方程式为_________。
(6)用电子式表示元素③与⑨形成化合物的过程_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X可能是由Na2SiO3、Fe、Na2CO3、 BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计实验方案如下图所示(所加试剂均过量)。

下列说法不正确的是:
A. 气体A一定是混合气体
B. 沉淀A一定是H2SiO3
C. 白色沉淀B在空气中逐渐变灰绿色,最后变红褐色
D. 该固体混合物一定含有Fe、Na2CO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现 “节能减排” 和“低碳经济”是化学工作者研究的重要课题。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)CO2和H2充入一定体积的密闭容器中,两种温度下CH3OH的物质的量随时间的变化见图1。曲线I、Ⅱ对应的平衡常数大小关系为KⅠ____KⅡ(填“>”、“<”或“=”)。

(2)某实验中将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图2曲线(甲)所示。
①a点正反应速率_________逆反应速率(填“>”、“<”或“=”);
0-10min内v(CH3OH) =__________mol·L-1·min-1。
②若仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线(乙)所示。曲线(乙)对应改变的实验条件可以是______填序号)。
A.加催化剂 B.增大压强
C.升高温度 D.增大CO2浓度
(3)830 ℃,反应的平衡常数K=1。在2L恒容反应器中发生上述反应,按下表中A、B、C、D四组的物质的量投入反应混合物,其中向正反应方向进行的有_____(填序号)。
物质 | A | B | C | D |
n(CO2) | 3 | 1 | 3 | 1 |
n(H2) | 2 | 2 | 4 | 0 |
n(CH3OH) | 1 | 2 | 3 | 0.5 |
n(H2O) | 0 | 2 | 3 | 2 |
(4)研究发现,在相同条件下还发生另一个平行反应CO2(g)+H2(g)![]() CO(g)+H2O(g)。CO2与H2用量相同,使用不同的催化剂时,产物中CO与CH3OH比例有较大差异,其原因是__________________________ 。
CO(g)+H2O(g)。CO2与H2用量相同,使用不同的催化剂时,产物中CO与CH3OH比例有较大差异,其原因是__________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2,发生如下两个反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0平衡常数K1
NaNO3(s)+ClNO(g) △H1<0平衡常数K1
②2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 平衡常数K2
2ClNO(g) △H2<0 平衡常数K2
10分钟时反应达到平衡,测得容器内体系的压强减少20%,10分钟内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10-3mol/(Lmin)。下列说法不正确的是( )
A.反应4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为
2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数为![]()
B.平衡后c(Cl2)=2.5×10-2mol/L
C.其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大
D.平衡时NO2的转化率为50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com