
【题目】下列关于有机物的说法不正确的是
A.苯和乙烯均可以使溴水褪色,但褪色原理不同
B.乳酸薄荷醇酯![]()
![]()
![]() 能发生水解、氧化、消去反应
能发生水解、氧化、消去反应
C.分子式为C4H11N的有机物,同分异构体有8种(不包括立体异构)
D.在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明有乙酸剩余
【答案】D
【解析】
A.苯不含双键;
B.含-OH、-COOC-,结合醇、酯的性质分析;
C.该有机物为饱和链状结构,N可以为氨基,也可以为-NH-或![]() ;
;
D.乙酸与碳酸钠反应生成二氧化碳气体,浓硫酸也可与碳酸钠反应生成气体,乙酸乙酯不能。
A.苯和溴水不反应,可发生萃取作用,而乙烯可与溴发生加成反应,二者原理不同,A正确;
B.含-OH,可发生取代,由于羟基连接的C原子的邻位C原子上含有H原子,可发生消去反应,含-COOC-可发生水解反应,B正确;
C.C4H11N是饱和链状结构,无不饱和键,无环状结构所以两种情况①N在末端C4H9-NH2,(以下省略H)C-C-C-C-N(丁胺)、(2-甲丙胺)、(1-甲丙胺)、(1,1-二甲乙胺),总共有4种;②N在内部,包括-NH-类型的C-C-N-C-C(N-乙基-乙胺)、C-N-C-C-C(N-甲基-丙胺)、(N-甲基-1-甲基-乙胺)3种外,还存在![]() 这种情况(N上没有H),所以满足条件的有机物总共8种,C正确;
这种情况(N上没有H),所以满足条件的有机物总共8种,C正确;
D.乙酸乙酯制备中加入了浓硫酸,也可与碳酸钠反应生成气体,不能说明醋酸剩余,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母)。
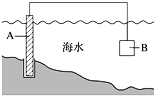
a.碳棒 b.锌板 c.铜板 d.钠块
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
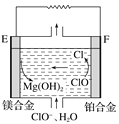
①E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式为__________
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_________。
③0.4molCuSO4和0.4molNaCl溶于水,配成1L溶液,用该镁燃料电池用惰性电极进行电解,当一个电极得到0.3molCu时,另一个电极上生成的气体在标准状况下的体积为_______L。
(3)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
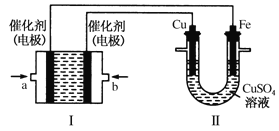
①b处应通入______(填“CH4”或“O2”),a处电极上发生的电极反应式是_________________;
②电镀结束后,装置Ⅰ中溶液的pH_____________;(填写“变大”“变小”或“不变”)装置Ⅱ中Cu2+的物质的量浓度_______________;(填写“变大”“变小”或“不变”)
③在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置Ⅰ中理论上消耗甲烷________L(标况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
元素 | H | Li | Be | B | C | N | O | F |
电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
元素 | Na | Mg | Al | Si | P | S | Cl | K |
电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,回答下列有关问题:
(1)估计钙元素的电负性的取值范围:___________< X <___________;
(2)据表中的所给数据分析,同主族内的不同元素X的值变化的规律是_____________________________;
(3)某元素的电负性数值为1.8,请你预测其可能具有的性质(填“金属性、非金属性”等)__________________________________;
(4)据上表电负性数据,试推断AlBr3中形成的化学键的类型为______________,试用电子式表示其形成过程___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
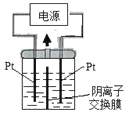
已知:3I2+6OH—=IO3—+5I—+3H2O
下列说法不正确的是
A. 右侧发生的电极方程式:2H2O+2e—=H2↑+2OH—
B. 电解结束时,右侧溶液中含有IO3—
C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”备受关注,CO2的捕集、利用与封存成为科学家研究的重要课题。
(1)绿色植物通过图1所示过程储存能量,用化学方程式表示其光合作用的过程:_______。
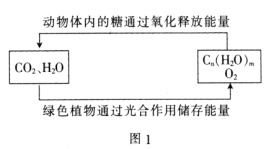
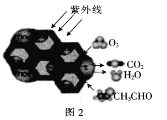
(2)TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物转化为CO2等小分子物质。图2为在TiO2的催化,O3降解CH3CHO的过程,则该反应的化学方程式为_____________________。
(3)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ/mol
CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJ/mol
O2(g)=CO2(g) △H2=-283 kJ/mol
CO(g)+H2O(g)=CO2(g)+2H2(g) △H3=-41 kJ/mol
则反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的 △H=___________________________。
2CO(g)+2H2(g)的 △H=___________________________。
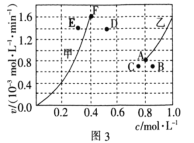
②为了探究反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图3):v正-c(CH4)和v逆-c(CO),则与v正-c(CH4)相对应的是图中曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图3):v正-c(CH4)和v逆-c(CO),则与v正-c(CH4)相对应的是图中曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3。
①在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭容器中,分别在不同温度下进行反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得的有关数据见下表(t1<t2<t3)。
2NH3(g)+CO2(g)。实验测得的有关数据见下表(t1<t2<t3)。
| 15 | 25 | 35 |
0 | 0 | 0 | 0 |
t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
氨基甲酸铵分解反应是_______(填“放热”或“吸热”反应)。15℃时,此反应的化学平衡常数K=____________________。
②在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____________________(已知常温下NH3·H2O的电离平衡常Kb=2×10-5,H2CO3的电离平衡常Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____________________(已知常温下NH3·H2O的电离平衡常Kb=2×10-5,H2CO3的电离平衡常Ka1=4×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下图所示。下列叙述正确的是

A. 有机物A可与溴水发生加成反应
B. 1mol有机物A能消耗2molNaOH
C. 有机物A不能使酸性高锰酸钾溶液褪色
D. 有机物A分子中所有碳原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯(如图所示)是一种食用香料。
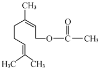
(1)乙酸橙花酯属于______(填“无机化合物”或“有机化合物”)。
(2)乙酸橙花酯中的官能团有________、_______(填名称)。
(3)将乙酸橙花酯加入饱和碳酸钠溶液中,充分震荡后分层,油层在上,说明乙酸橙花酯的密度___水的密度(填“大于”“小于”)。
(4)向乙酸橙花酯溶液中滴入几滴溴水,实验现象为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com