
【题目】“低碳经济”备受关注,CO2的捕集、利用与封存成为科学家研究的重要课题。
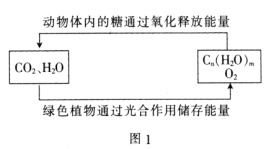
(1)绿色植物通过图1所示过程储存能量,用化学方程式表示其光合作用的过程:_______。
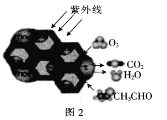
(2)TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物转化为CO2等小分子物质。图2为在TiO2的催化,O3降解CH3CHO的过程,则该反应的化学方程式为_____________________。
(3)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ/mol
CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJ/mol
O2(g)=CO2(g) △H2=-283 kJ/mol
CO(g)+H2O(g)=CO2(g)+2H2(g) △H3=-41 kJ/mol
则反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的 △H=___________________________。
2CO(g)+2H2(g)的 △H=___________________________。
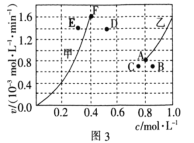
②为了探究反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图3):v正-c(CH4)和v逆-c(CO),则与v正-c(CH4)相对应的是图中曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图3):v正-c(CH4)和v逆-c(CO),则与v正-c(CH4)相对应的是图中曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3。
①在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭容器中,分别在不同温度下进行反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得的有关数据见下表(t1<t2<t3)。
2NH3(g)+CO2(g)。实验测得的有关数据见下表(t1<t2<t3)。
| 15 | 25 | 35 |
0 | 0 | 0 | 0 |
t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
氨基甲酸铵分解反应是_______(填“放热”或“吸热”反应)。15℃时,此反应的化学平衡常数K=____________________。
②在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____________________(已知常温下NH3·H2O的电离平衡常Kb=2×10-5,H2CO3的电离平衡常Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____________________(已知常温下NH3·H2O的电离平衡常Kb=2×10-5,H2CO3的电离平衡常Ka1=4×10-7)。
【答案】nCO2+mH2O ![]() Cn(H2O) m+nO2 5O3+3CH3CHO
Cn(H2O) m+nO2 5O3+3CH3CHO![]() 6CO2+6H2O +248 kJ/mol 乙 E 吸热 4×10-6 1.25×10-3
6CO2+6H2O +248 kJ/mol 乙 E 吸热 4×10-6 1.25×10-3
【解析】
(1)绿色植物在光照条件下将CO2、H2O反应转化为Cn(H2O) m,同时放出O2;
(2)根据图示的反应物、生成物,结合原子守恒书写方程式;
(3)①根据盖斯定律,将已知的热化学方程式叠加,可得待求反应的热化学方程式;
②CH4与CO2其起始的物质的量浓度均为1.0 mol/L,且随着反应的进行,甲烷的浓度会越来越小,正反应速率也会越来越小,据此判断,根据图可知,反应平衡时图中对应的点应为A和F点,降温后,反应速率减小,平衡逆向移,甲烷的浓度会增大,据此判断;
(4)①根据表中温度对产生气体的浓度的影响分析,根据表中数据求反应NH2COONH4(s) ![]() 2NH3(g)+CO2(g)的平衡常数,要利用表中数据求出NH3、CO2的浓度,带入平衡常数表达式进行计算;
2NH3(g)+CO2(g)的平衡常数,要利用表中数据求出NH3、CO2的浓度,带入平衡常数表达式进行计算;
②利用化学平衡常数的含义,将物质的浓度带入平衡常数定义式,结合物质的电离平衡常数计算分析。
(1)绿色植物在光照条件下将CO2、H2O反应转化为Cn(H2O) m,同时放出O2,反应的方程式为:nCO2+mH2O ![]() Cn(H2O) m+nO2;
Cn(H2O) m+nO2;
(2)O3在TiO2及紫外线作用下将CH3CHO氧化为CO2,O3被还原为CO2、H2O,反应方程式为:5O3+3CH3CHO![]() 6CO2+6H2O;
6CO2+6H2O;
(3)①(i)CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ/mol
(ii)CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJ/mol
O2(g)=CO2(g) △H2=-283 kJ/mol
(iii)CO(g)+H2O(g)=CO2(g)+2H2(g) △H3=-41 kJ/mol
Z根据盖斯定律,将(i)-4×(ii)+2×(iii),整理可得反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的 △H=+248 kJ/mol;
2CO(g)+2H2(g)的 △H=+248 kJ/mol;
②CH4与CO2其起始的物质的量浓度均为1.0 mol/L,且随着反应的进行,甲烷的浓度会越来越小,正反应速率也会越来越小,所以曲线v正-c(CH4)相对应的是图中曲线是乙线,根据图可知,反应平衡时图中对应的点应为A和F点,降温后,反应速率减小,平衡逆向移动,甲烷的浓度会增大,所以此时曲线甲对应的平衡点可能为B点,CO的浓度也会减小,对应的为E点;
(4)①从表中数据可以看出,随着温度升高,气体的总浓度增大,说明升高温度,化学平衡正向移动,根据平衡移动原理,升高温度,化学平衡向吸热反应分析移动,因此该反应为吸热反应;根据表中数据可知,在15℃时,c(NH3)=3×10-2×![]() mol/L=2×10-2 mol/L,c(CO2)=3×10-2×
mol/L=2×10-2 mol/L,c(CO2)=3×10-2×![]() mol/L=1×10-2 mol/L,,所以反应NH2COONH4(s)
mol/L=1×10-2 mol/L,,所以反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)的平衡常数K=c2(NH3)×c(CO2)=(2×10-2mol)
2NH3(g)+CO2(g)的平衡常数K=c2(NH3)×c(CO2)=(2×10-2mol)
②已知常温下NH3H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=
NH3·H2O+H2CO3的平衡常数K=
=1.25×10-3。


科目:高中化学 来源: 题型:
【题目】图中甲池的总反应式为![]() 。
。
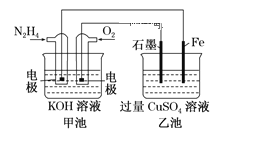
(1)甲池中负极上的电极反应式为_____________________。
(2)乙池中石墨电极上电极反应式为_________________________________。
(3)要使乙池恢复到电解前的状态,应向溶液中加入适量的 _______________。
A.CuO B.Cu(OH)2 C.CuCO3 D.CuSO4
(4)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6gN2H4时,乙池中两个电极质量差为_________________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)油脂属于_________类,其在碱性条件下的水解反应又称_________反应,产物为_________(写名称);
(2)在蔗糖和麦芽糖中,_________能发生银镜反应,二者_________同分异构体(填“属于”或“不属于”);蔗糖的水解反应式为_________;
(3)甲醛能使_________变性凝固,所以可用其稀溶液浸制生物标本;甲醛还是非常重要的合成原料,纯净的甲醛在一定条件下加聚生成聚甲醛(是一种优良的工程塑料),聚甲醛的结构简式为_________;俄国化学家布特列洛夫在1861年首次发现在弱碱作用下,6个甲醛分子加合得到己糖,此己糖的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法不正确的是
A.苯和乙烯均可以使溴水褪色,但褪色原理不同
B.乳酸薄荷醇酯![]()
![]()
![]() 能发生水解、氧化、消去反应
能发生水解、氧化、消去反应
C.分子式为C4H11N的有机物,同分异构体有8种(不包括立体异构)
D.在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明有乙酸剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验,另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1,请回答如下问题:
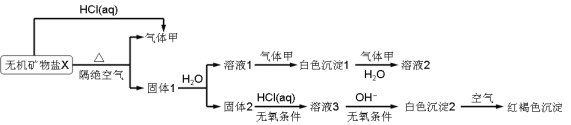
(1)画出白色沉淀1中金属元素的原子结构示意图____________,写出气体甲的电子式____________。
(2)在惰性气流中加热X至完全分解的化学反应方程式为________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式___________,并设计实验方案验证该反应的产物___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3= 7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是:

A.电流从左侧A电极经过负载后流向右侧B电极
B.当有4.48 L NO2被处理时,转移电子数为0.8NA
C.电极A极反应式为2NH3-6e-= N2+6H+
D.为使电池持续放电,离子交换膜需选用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。

(1)图中甲池中OH-移向 极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为 极(填“A”或"B”),并写出此电极的反应式:____ 。
(4)乙池中总反应的离子方程式:____ 。
(5)当乙池中B(Ag)极的质量增加5.4g时,乙池的pH是 (若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是 (填序号)。
A. MgSO4 B.CuSO4 C.AgNO3 D.AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是( )

A.40 ℃之前,温度升高反应速率加快,变蓝时间变短
B.40 ℃之后溶液变蓝的时间随温度的升高变长
C.图中b、c两点对应的NaHSO3的反应速率相等
D.图中a点对应的NaHSO3的反应速率为5.0×10-5mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.由CH4、O2和KOH溶液组成的燃料电池,负极反应为CH4+8OH--8e-=CO2+6H2O
B.常温下,反应2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)能自发进行,该反应ΔH<0
C.反应C(s)+H2O(g)![]() CO(g)+H2(g)达平衡后,缩小容器体积,H2O(g)平衡转化率不变
CO(g)+H2(g)达平衡后,缩小容器体积,H2O(g)平衡转化率不变
D.0.1 mol·L-1 NH4Cl溶液加水稀释,![]() 的值减小
的值减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com