
����Ŀ��ij�о�С��Ϊ��̽��һ����������X(��������Ԫ��)����ɺ����ʣ���Ʋ��������ʵ�飬��ȡ10.80 g X�ڶ��������м�������ȫ�ֽ⣬�õ�6.40 g����1����ش��������⣺
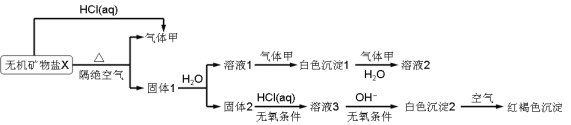
(1)������ɫ����1�н���Ԫ�ص�ԭ�ӽṹʾ��ͼ____________��д������ĵ���ʽ____________��
(2)�ڶ��������м���X����ȫ�ֽ�Ļ�ѧ��Ӧ����ʽΪ________________________��
(3)��ɫ����2�ڿ����б�ɺ��ɫ������ԭ����_________________(�û�ѧ��Ӧ����ʽ��ʾ)��
(4)һ�������£�����������1�е�ij�ֳɷֿ��ܷ���������ԭ��Ӧ��д��һ�����ܵĻ�ѧ��Ӧ����ʽ___________�������ʵ�鷽����֤�÷�Ӧ�IJ���___________��
���𰸡�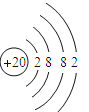
![]() CaFe(CO3)2
CaFe(CO3)2![]() CaO+FeO+2CO2�� 4Fe(OH)2+2H2O+O2=4Fe(OH)3 2FeO+CO2
CaO+FeO+2CO2�� 4Fe(OH)2+2H2O+O2=4Fe(OH)3 2FeO+CO2![]() Fe2O3+CO ȡ�����������Թ��У����������ܽ⣬Ȼ����뼸��KSCN��Һ������Һ���ɫ��˵�������к���+3��Fe3+
Fe2O3+CO ȡ�����������Թ��У����������ܽ⣬Ȼ����뼸��KSCN��Һ������Һ���ɫ��˵�������к���+3��Fe3+
��������
X�ܺ�HCl��Ӧ��������ף�������������X�õ��������1���²�X��̼���Σ���ΪX�����ֽ����ܺ��ᷴӦ����CO2����ô��ΪCO2������1����ˮ�õ���Һ1����2����Һ1�Ͷ�����̼��Ӧ���ɰ�ɫ����1����ɫ����1�Ͷ�����̼��ˮ��Ӧ������Һ2�����ɫ����1Ϊ̼���Ρ���Һ2Ϊ̼�����Σ�
����2��ϡ���ᷴӦ������Һ3������Ҫ������������Һ3�м�������������������ɰ�ɫ����2����ɫ����2�������������ɺ��ɫ���������ɫ����2��Fe(OH)2����Һ3ΪFeCl2��X����4��Ԫ�أ�̼���ηֽ����ɶ�����̼������������������һ��������������ˮ����CO2��Ӧ�ܺIJ�����ɫ����1���ɲ²����1�гɷ�ΪCaO��FeO����Ӧ�أ�XӦΪCaFe(CO3)2�����������Ϣ��10.80 gX�ڶ��������м�������ȫ�ֽ⣬�õ�6.40 g����1�������㣬ȷ��XΪCaFe(CO3)2����ô����Һ1��Ca(OH)2����ɫ����1��CaCO3����Һ2��Ca(HCO3)2���ٽ����Ŀ�������
��������������֪���������CO2������1��CaO��FeO�Ļ�����Һ1��Ca(OH)2����ɫ����1��CaCO3����Һ2��Ca(HCO3)2����ɫ����2��Fe(OH)2����Һ3ΪFeCl2�������2��FeO����Ӧ�أ�X�ڶ��������м�������ȫ�ֽ⣬�õ�6.40g����1�������㣬ȷ��XӦΪCaFe(CO3)2��
(1)��ɫ����1��CaCO3��̼����н���Ԫ�ص�Ca��20��Ԫ�أ�ԭ�Ӻ�������Ų�Ϊ2��8��8��2����Caԭ�ӽṹʾ��ͼΪ ���������CO2��Cԭ����2��Oԭ���γ�4�Թ��õ��Ӷԣ�����ʽΪ
���������CO2��Cԭ����2��Oԭ���γ�4�Թ��õ��Ӷԣ�����ʽΪ![]() ��
��
(2)ͨ�����Ϸ���֪��X�Ļ�ѧʽ��CaFe(CO3)2���ڶ��������м���X����ȫ�ֽ����ɶ�����̼�������ơ��������������Ը÷�Ӧ�Ļ�ѧ��Ӧ����ʽΪCaFe(CO3)2![]() CaO+FeO+2CO2����
CaO+FeO+2CO2����
(3)��ɫ����2��Fe(OH)2���������������ȶ����ױ������������ɺ��ɫ��������������ɫ����2�ڿ����б�ɺ��ɫFe(OH)3�ķ���ʽΪ4Fe(OH)2+2H2O+O2=4Fe(OH)3��
(4)һ�������£�����������1�е�ij�ֳɷֿ��ܷ���������ԭ��Ӧ��FeO���л�ԭ�ԣ��ܱ�CO2����������������������������ͬʱ����CO����Ӧ����ʽΪ2FeO+CO2![]() Fe2O3+CO(������Fe3O4)������÷�Ӧ�����������ɹ����к���+3������ȡ�����������Թ��У����������ܽ⣬Ȼ����뼸��KSCN��Һ������Һ���ɫ��˵�������к���+3��Fe3+��
Fe2O3+CO(������Fe3O4)������÷�Ӧ�����������ɹ����к���+3������ȡ�����������Թ��У����������ܽ⣬Ȼ����뼸��KSCN��Һ������Һ���ɫ��˵�������к���+3��Fe3+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25mL 0.1mol��L-1NaOH��Һ����μ���0.2mol��L-1CH3COOH��Һ����ҺpH�仯������ͼ��ʾ�������й�����Ũ�ȵıȽ���ȷ����

A.��A��B����һ��(����A��B��)����Һ�п�����c(Na+)>c(CH3COO��)>c(OH��)>c(H+)
B.��B�㣬a>12.5������c(Na+)=c(CH3COO��)=c(OH��)=c(H+)
C.��C�㣬c(CH3COO��)>c(Na+)>c(OH��)>c(H+)
D.��D�㣬c(CH3COO��)+c(CH3COOH)=c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
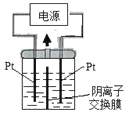
����Ŀ����ˮ�����ǽ���غ���������ˮ����Ĺؼ���������ͼ�ǵ�������������ˮװ�õĹ���ԭ��ʾ��ͼ(�����ڲ�������������������ʾ��ͬ���͵����ӽ���Ĥ)������������b�缫�ϳ�������Cl2�����й��ڸ�װ�õ�˵���������
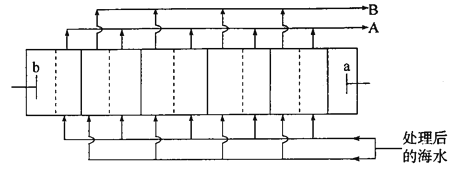
A. ����������b�����Ƹ���a��
B. ��������ʾ�����ӽ���Ĥ����������ʾ�����ӽ���Ĥ
C. ��ˮԤ������Ҫ�dz�ȥCa2����Mg2����
D. A������������Ũˮ����B���������ǵ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����װ����ͼ��ʾ��������װ��KI��������Һ���м��������ӽ���Ĥ��������һ���ĵ�ѹ��ͨ�磬���������Һ����ɫ��һ��ʱ�����ɫ��dz��
��֪:3I2+6OH��=IO3��+5I��+3H2O
����˵������ȷ����
A. �Ҳ���ĵ缫����ʽ��2H2O+2e��=H2��+2OH��
B. ������ʱ���Ҳ���Һ�к���IO3��
C. �����ڷ�����Ӧ���ܻ�ѧ����ʽKI+3H2O=KIO3+3H2��
D. ����������ӽ���Ĥ���������ӽ���Ĥ�������ڷ������ܻ�ѧ����ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ka��CH3COOH��=1.7��10-5��Kb��NH3��H2O��=1.7��10-5��25��ʱ����40mlŨ�Ⱦ�Ϊ0.01mol��L-1������ʹ��ᣨ1:1�������Һ����μ���0.10mol��L-1�İ�ˮ���ⶨ�����е絼�ʺ�pH�仯������ͼ��ʾ������˵����ȷ����

A. a����Һ�У�c(CH3COO-)������ԼΪ10-5
B. b����Һ�У�c(NH4+) < c(CH3COOH)
C. c����Һ�У�c(NH4+) > c(Cl-)+c(CH3COO-)
D. d��ˮ�ĵ���̶ȴ���c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼���������ܹ�ע��CO2�IJ��������������Ϊ��ѧ���о�����Ҫ���⡣
(1)��ɫֲ��ͨ��ͼ1��ʾ���̴����������û�ѧ����ʽ��ʾ�������õĹ��̣�_______��
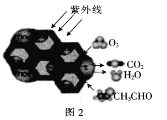
(2)TiO2��һ�����������İ뵼������,����Ч�ؽ��л���Ⱦ��ת��ΪCO2��С�������ʡ�ͼ2Ϊ��TiO2�Ĵ���O3����CH3CHO�Ĺ���,��÷�Ӧ�Ļ�ѧ����ʽΪ_____________________��
(3)��һ������CO2(g)��CH4(g)ͨ��һ�����ܱ������з�����ӦCO2(g)+CH4(g)![]() 2CO(g)+2H2(g)��
2CO(g)+2H2(g)��
����֪��CH4(g)+2O2(g)=CO2(g)+2H2O(g) ��H1=-802 kJ/mol
CO(g)+![]() O2(g)=CO2(g) ��H2=-283 kJ/mol
O2(g)=CO2(g) ��H2=-283 kJ/mol
CO(g)+H2O(g)=CO2(g)+2H2(g) ��H3=-41 kJ/mol
��ӦCO2(g)+CH4(g)![]() 2CO(g)+2H2(g)�� ��H=___________________________��
2CO(g)+2H2(g)�� ��H=___________________________��
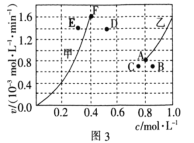
��Ϊ��̽����ӦCO2(g)+CH4(g)![]() 2CO(g)+2H2(g)�ķ�Ӧ������Ũ�ȵĹ�ϵ����ʼʱ������ܱ�������ͨ��CO2��CH4��ʹ�����ʵ���Ũ�Ⱦ�Ϊ1.0mol/L��ƽ��ʱ������������ݻ��Ƴ�������Ӧ������Ũ�ȹ�ϵ����(��ͼ3)��v��-c(CH4)��v��-c(CO)������v��-c(CH4)���Ӧ����ͼ������________(����������������)���÷�Ӧ�ﵽƽ���ijһʱ�̽����¶�,��Ӧ���´ﵽƽ�⣬���ʱ����Ӧ��ƽ������Ϊ________(����D����E������F��)��
2CO(g)+2H2(g)�ķ�Ӧ������Ũ�ȵĹ�ϵ����ʼʱ������ܱ�������ͨ��CO2��CH4��ʹ�����ʵ���Ũ�Ⱦ�Ϊ1.0mol/L��ƽ��ʱ������������ݻ��Ƴ�������Ӧ������Ũ�ȹ�ϵ����(��ͼ3)��v��-c(CH4)��v��-c(CO)������v��-c(CH4)���Ӧ����ͼ������________(����������������)���÷�Ӧ�ﵽƽ���ijһʱ�̽����¶�,��Ӧ���´ﵽƽ�⣬���ʱ����Ӧ��ƽ������Ϊ________(����D����E������F��)��
(4)��ϡ��ˮ��������CO2���տɵò�ƷNH4HCO3��
���ڲ���ʱ�����������м���NH2COONH4(���������)���ɡ��ֽ�һ���������İ�����������ں����ܱ������У��ֱ��ڲ�ͬ�¶��½��з�Ӧ��NH2COONH4(s)![]() 2NH3(g)+CO2(g)��ʵ���õ��й����ݼ��±�(t1<t2<t3)��
2NH3(g)+CO2(g)��ʵ���õ��й����ݼ��±�(t1<t2<t3)��
| 15 | 25 | 35 |
0 | 0 | 0 | 0 |
t1 | 9��10-3 | 2.7��10-2 | 8.1��10-2 |
t2 | 3��10-2 | 4.8��10-2 | 9.4��10-2 |
t3 | 3��10-2 | 4.8��10-2 | 9.4��10-2 |
��������立ֽⷴӦ��_______(����������������������Ӧ)��15��ʱ���˷�Ӧ�Ļ�ѧƽ�ⳣ��K=____________________��
����NH4HCO3��Һ�У���ӦNH4++HCO3-+H2O![]() NH3��H2O+H2CO3��ƽ�ⳣ��K=_____________________(��֪������NH3��H2O�ĵ���ƽ�ⳣKb=2��10-5��H2CO3�ĵ���ƽ�ⳣKa1=4��10-7)��
NH3��H2O+H2CO3��ƽ�ⳣ��K=_____________________(��֪������NH3��H2O�ĵ���ƽ�ⳣKb=2��10-5��H2CO3�ĵ���ƽ�ⳣKa1=4��10-7)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����һ�����pH=12��Ba(OH)2��Һ�У���μ���һ�����ʵ���Ũ�ȵ�NaHSO4��Һ������Һ�е�Ba2+ǡ����ȫ����ʱ����ҺpH=11����������ԼӺͣ���V (Ba(OH)2)��V( NaHSO4)Ϊ( )
A.1��1B.1��4C.2��1D.3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ͷ������������������а�������Ҫ�Ľ�ɫ�����ݴ��ͷӵĸ�������ʻش��������⡣
��1�������������ڷ������__________��д���ݷ�����ȥ��Ӧ�Ļ�ѧ����ʽ��ע����Ӧ������____��
��CH3CH2CH2OH��CH3CH(OH)CH3��CH2=CH-CH2OH��CH2OH-CH2OH�� ��
�� ��
��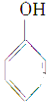
��2��˾���ƺ�ݳ�ʱ�ɼ�������������壬�����õĻ�ѧ��Ӧ���£�2CrO3(��ɫ)��3C2H5OH��3H2SO4===Cr2(SO4)3(��ɫ)��3CH3CHO��6H2O����������ɷ���__________��������Ӧ�е���������____________����ԭ����____________��
��3��300����ǰ��������ѧ�Ҳ����������������ûʳ�������ɫ��Ӧ�����ɴ˷���������īˮ��ûʳ����Ľṹ��ʽ��ͼ��д��ûʳ�����к��еĹ���������_____________��ûʳ��������īˮ��Ҫ������__________����������(�����)��

A���� B���� C����֬ D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A.��Cl2ͨ���ȵ�NaOH��Һ��Cl2��6OH��![]() Cl����ClO3����3H2O
Cl����ClO3����3H2O
B.�ô����ˮ����2CH3COOH��CO32-=2CH3COO����H2O��CO2��
C.����FeSO4��Һ���ڷ��÷������ʣ�4Fe2����O2��4H��=4Fe3����2H2O
D.��NH4HCO3��Һ�м������NaOH��Һ�����ȣ�NH4+��OH��![]() NH3����H2O
NH3����H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com