
【题目】海水淡化是解决沿海城市饮用水问题的关键技术。下图是电渗析法淡化海水装置的工作原理示意图(电解槽内部的“┆”和“│”表示不同类型的离子交换膜)。工作过程中b电极上持续产生Cl2。下列关于该装置的说法错误的是
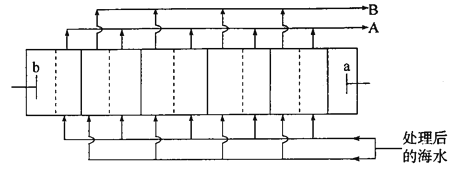
A. 工作过程中b极电势高于a极
B. “┆”表示阴离子交换膜,“│”表示阳离子交换膜
C. 海水预处理主要是除去Ca2+、Mg2+等
D. A口流出的是“浓水”,B口流出的是淡水
【答案】D
【解析】
电解过程中b电极上持续产生Cl2,则电极b为电解池阳极,氯离子放电生成氯气,电极反应为:2Cl--2e-=Cl2↑,电极a为电解池的阴极,溶液中氢离子得到电子生成氢气,电极反应为2H++2e-=H2↑,工作过程中,氯离子向b移动,因此虚线为阴离子交换膜,钠离子向a移动,实线为阳离子交换膜,据此分析解答。
A.电极b为电解池阳极,电极a为电解池的阴极, b极电势高于a极,故A正确;
B.根据分析, “┆”表示阴离子交换膜,“│”表示阳离子交换膜,故B正确;
C.为了防止海水中的Ca2+、Mg2+、SO42-等堵塞离子交换膜,影响电解,电解前,海水需要预处理,除去其中的Ca2+、Mg2+等,故C正确;
D.根据分析,实线为阳离子交换膜,虚线为阴离子交换膜,钠离子向a移动,氯离子向b移动,各间隔室的排出液中,A口流出的是淡水, B口流出的是“浓水”,故D错误;
答案选D。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
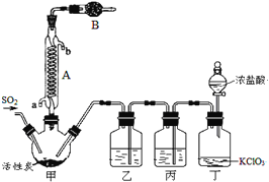
(1)仪器A冷却水的进口为___(填“a”或“b”)。
(2)仪器B中盛放的药品是___。此仪器作用为:___。
(3)实验时,装置丁中发生反应的离子方程式为___。
(4)装置丙的作用为___,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为___。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H═H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是___。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是( )

A. 根据图甲可知合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g) △H1=(b-a)kJ·mol-1
B. 图乙表示2mol H2(g)所具有的能量比2mol气态水所具有的能量多483.6kJ
C. 1mol NaOH分别和1mol CH3COOH、1mol HNO3反应,后者比前者△H小
D. 汽油燃烧时将全部的化学能转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()

A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是
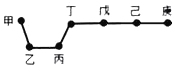
A.简单气态氢化物的稳定性:庚>己>戊>丁
B.单质甲与单质乙充分反应一定都可以生成多种化合物
C.可以通过分别电解熔融的金属氯化物的方法冶炼乙和丙的单质
D.因为庚元素的非金属性最强,所以庚的最高价氧化物对应水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)油脂属于_________类,其在碱性条件下的水解反应又称_________反应,产物为_________(写名称);
(2)在蔗糖和麦芽糖中,_________能发生银镜反应,二者_________同分异构体(填“属于”或“不属于”);蔗糖的水解反应式为_________;
(3)甲醛能使_________变性凝固,所以可用其稀溶液浸制生物标本;甲醛还是非常重要的合成原料,纯净的甲醛在一定条件下加聚生成聚甲醛(是一种优良的工程塑料),聚甲醛的结构简式为_________;俄国化学家布特列洛夫在1861年首次发现在弱碱作用下,6个甲醛分子加合得到己糖,此己糖的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工、农业废水以及生活污水中浓度较高的![]() 会造成氮污染。工业上处理水体中
会造成氮污染。工业上处理水体中![]() 的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
(1)先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。
①除锈反应的离子反程式是__________。
②判断铁屑洗净的方法是__________。
(2)将KNO3溶液的pH调至2.5。从氧化还原的角度分析调低溶液pH的原因是__________。
(3)将上述处理过的足量铁屑投入(2)的溶液中。如图表示该反应过程中,体系内相关离子浓度、pH随时间变化的关系。请根据图中信息回答:

①t1时刻前该反应的离子方程式是__________。
②t2时刻后,该反应仍在进行,溶液中![]() 的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
(4)铁屑与KNO3溶液反应过程中向溶液中加入炭粉,可以增大该反应的速率,提高![]() 的去除效果,其原因是__________。
的去除效果,其原因是__________。
【答案】 Fe2O3+6H+=2Fe3++3H2O 测最后一次洗涤液的pH,若为7,则说明铁屑已洗净(或取少量最后一次洗涤液加入BaCl2溶液,若无明显现象,则说明铁屑已洗净) ![]() 在酸性条件下的氧化性强,易被铁屑还原 4Fe+
在酸性条件下的氧化性强,易被铁屑还原 4Fe+![]() +10H+=4Fe2++
+10H+=4Fe2++![]() +3H2O 生成的Fe2+水解 炭粉和铁构成了无数微小的原电池加快反应速率
+3H2O 生成的Fe2+水解 炭粉和铁构成了无数微小的原电池加快反应速率
【解析】(1). ①. 铁锈的主要成分是Fe2O3,与稀硫酸反应生成硫酸铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
②. 判断铁屑是否洗净的方法是测最后一次洗涤液的pH,若为7,则说明铁屑已洗净,故答案为:测最后一次洗涤液的pH,若为7,则说明铁屑已洗净;
(2). pH调至2.5,是因为NO3-在酸性条件下的氧化性强,易被铁屑还原,故答案为:NO3-在酸性条件下的氧化性强,易被铁屑还原;
(3). ①. 根据图示可知,在t1时刻前,硝酸根离子、氢离子浓度逐渐减小,亚铁离子浓度增大,则在t1时刻前是金属铁和硝酸之间的反应,即4Fe+NO3-+10H+=4Fe2++NH4++3H2O,故答案为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
②. 根据反应4Fe+NO3-+10H+=4Fe2++NH4++3H2O可知,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,所以原因是生成的Fe2+水解所致,故答案为:生成的Fe2+水解;
(4). 构成原电池可以加快化学反应速率,炭粉和铁屑构成了无数微小的原电池加快反应速率,故答案为:炭粉和铁构成了无数微小的原电池加快反应速率。
点睛:本题主要考查硝酸、铁及其化合物的化学性质,试题难度中等。熟练掌握硝酸的化学性质和铁及其化合物的性质是解答本题的关键,本题的难点是第(3)问,解答本问时,需先仔细审图,根据图示得出t1时刻前,硝酸根离子、氢离子浓度是逐渐减小的,亚铁离子浓度是逐渐增大的,所以t1时刻前是金属铁和硝酸之间的反应,随着反应的进行,溶液中铵根离子浓度在增大,亚铁离子的浓度却没有增大,说明是生成的亚铁离子发生了水解反应,据此解答本题即可。
【题型】综合题
【结束】
18
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:

已知:CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积常数如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 | 9.1×10-6 | 2.30×10-2 | 1.17×10-10 | 1.08×10-10 |
(1)用离子方程式表示K2Cr2O7溶液中同时存在K2CrO4的原因(将离子方程式补充完整):
![]() +__________=
+__________=![]() +__________。____________
+__________。____________
(2)向滤液1中加入BaCl2·2H2O的目的,是使![]() 从溶液中沉淀出来。
从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用:__________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由:__________。
③研究温度对![]() 沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下
沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下![]() 的沉淀率
的沉淀率 ,如下图所示。
,如下图所示。

已知:BaCrO4(s) ![]() Ba2+(aq)+
Ba2+(aq)+ ![]() ΔH>0
ΔH>0
![]() 的沉淀效率随温度变化的原因是__________。
的沉淀效率随温度变化的原因是__________。
(3)向固体2中加入硫酸,回收重铬酸。
①硫酸浓度对重铬酸的回收率如下图所示。结合化学平衡移动原理,解释使用0.450mol/L的硫酸时,重铬酸的回收率明显高于使用0.225mol/L的硫酸的原因:__________。

②回收重铬酸的原理如图所示。当硫酸浓度高于0.450mol/L时,重铬酸的回收率没有明显变化,其原因是__________。

(4)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与__________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验,另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1,请回答如下问题:
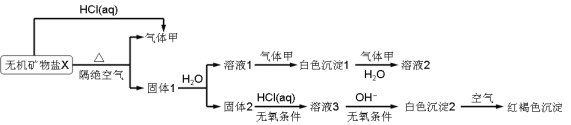
(1)画出白色沉淀1中金属元素的原子结构示意图____________,写出气体甲的电子式____________。
(2)在惰性气流中加热X至完全分解的化学反应方程式为________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式___________,并设计实验方案验证该反应的产物___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按![]() 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(![]() )与温度(T)、
)与温度(T)、![]() 的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的是
的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的是

A. 图甲中![]()
B. 若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将不变
C. 温度T1、![]() , Cl2的转化率约为33.3%
, Cl2的转化率约为33.3%
D. 图乙中,线A表示正反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com